Жизнь растений
Основные систематические группы бактерий и актиномицетов
В настоящей книге авторы придерживались в основном системы бактерий и актиномицетов, разработанной крупнейшим советским микробиологом Н. А. Красильниковым в его «Определителе бактерий и актиномицетов» (1949).
Эубактерии и родственные им организмы, по Н. А. Красильникову, подразделяются на 4 класса:
Eubacteriae (истинные бактерии).
Actinomycetes (актиномицеты).
Myxobacteriae (миксобактерии).
Spirochaetae (спирохеты).
В класс Eubacteriae (истинные бактерии) входят организмы с неветвящимися клетками и прочными клеточными стенками, имеющими форму мелких тонких палочек, реже кокков, находятся также нитевидные и спиралевидные формы. Часть эубактерий обладает подвижностью, часть — неподвижные. Движение осуществляется при помощи жгутиков простого строения, состоящих из взаимно перевитых фибрилл.
Часть эубактерий способна формировать эндогенно (внутри клеток) термоустойчивые споры, большинство же представлено неспороносными грамотрицательными формами. Размножаются эубактерии делением, некоторые нитчатые бактерии образуют специальные репродуктивные клетки — гонидии.
Класс Eubacteriae объединяет порядки: Eubacteriales (эубактерии), Chlamydobacteriales (хламидобактерии), Ferribacteriales (железобактерии), Thiobacteriales (серобактерии).
В пределах этого класса могут рассматриваться на уровне порядков почкующиеся бактерии (Hyphomicrobiales), приводящиеся в «Определителе бактерий и актиномицетов» Н. А. Красильникова в группе неклассифицированных организмов, а также многоклеточные бесцветные бактерии, сходные с сине-зелеными водорослями и выделяемые М. А. Пешковым в отдельный порядок Caryophanales.
Таблица. Основные систематические группы
| EUBACTERIALES. Одноклеточные бактерии шаровидной, палочковидной и спиралевидной формы. Грамотрицательные и грамположительные. Раэммножаются поперечным делением клеток. Большинство подвижные. Жгутики расположены полярно на концах клеток или перитрихиально. Некоторые представители способны образовывать эндогенно термоустойчивые споры. Разнообразны по физиологическим свойствам: автотрофы и гетеротрофы. Очень широко распространены в природе. | 1. Грамотрицательные неспоробразующие палочки с одним жгутиком. Типичные представители порядка. Сильно различаются по физиологическим признакам: гетеротрофизм, паразитизм, облигатная галофилия. ) | Pseudomonas, Xanthomonas, Azotomonas, Acetomonas, Aeromonas, Zymomonas, Acetobacter, Bdellovibrio, Halobacterium |
| 2. Неспороносные грамотрицательные палочки с перитрихиальнм жгутикованием. Некоторые представители неподвижны. Гетеротрофы. Есть патогенные формы возбудители тифа, дизентирии, чумы. Представители родов Azotobacter, Bejerinckia могут фиксировать атмосферный азот. Некоторые виды размножаются почкованием (Agrobacterium, Tuberoidobacter). Имеются организмы необычной морфологии: Seliberia, Tuberoidobacter | Bacterium, Serratia, Salmonella, Shigella, Erwinia, Aerobacter, Klebsiella, Proteus, Pasteurella, Chromobacterium, Flavobacterium, Fusobacterium, Achromobacter, Alcaligenes, Beneckea, Agarbacterium, Azotobacter, Bejerinckia, Rhizobium, Agrobacterium, Tuberoidobacter, Seliberia, Haemophilus, Bordetella, Moraxella | |
| 3. Bacillaceae. Грамположительные и грамотрицательные палочковидные бактерии. Способны формировать термоустойчивые эндоспоры. Аэробы (род Bacillus) и анаэробы (роды С1оstridium, Desulfotomaculum). Гетеротрофы | Bacillus, Clostridium, Desulfotomaculum | |
| 4. Spirillaceae. Грамотрицательные бактерии. Клетки имеют вид слабо (вибрионы) или сильно (спириллы) изогнутых палочек с жесткой клеточной стейкой. Аэробы и анаэробы. Гетеротрофы. Есть возбудители болезней (холера) | Vibrio, Cellvibrio, Cellfalcicola, Microcyclus, Spirosoma, Benobacter, Spirillum, Desulfovibrio, Selenomonas | |
| 5. Planococcaceae. Шаровидные Грамположительные подвижные бактерии. Клетки одиночные (род Р1аnococcus) или соединены в группы (род Planosarcina). Гетеротрофы | Planococcus, Planosarcina | |
| FERRIBACTERIALES. Сборная группа одноклеточных бактерий, обладающих способностью откладывать вокруг клеток соединения железа | 1. Ferribacteriaceae. Клетки образуют слизистые стебельки, на которых откладывается гидрат окиси железа. Гетеротрофы | Gallionella, Nevskia, Pasteuria |
| 2. Siderocapsaceae. Клетки образуют слизистую капсулу, иногда капсул нет. Гетеротрофы | Siderocapsa, Sideromonas, Ochrobium, Naumanniella, Siderococcus, Ferrobacillus, Ferribacterium | |
| HYPHOMICROBIALES. Гетеротрофные грамотрицательные неспорообразующие бактерии, клетки которых обладают протоплазматическими выростами - гифами. Размножаются путем образования почек на концах гиф. | Hyphomicrobiaceae. Характеристика та же, что и для порядка | Hyphomicrobium, Pedomicrobium, Ancalomicrobium, Prosthecomicrobium, Blastobacter, Blastocaulis |
| THIOBACTERIALES. Сборная группа одноклеточных бактерий, которые при окислении сероводорода откладывают внутри клеток капельки серы | Achromatiaceae. Типичные представители порядка. Бесцветные одноклеточные бактерии. Аэробы. Гетеротрофы | Achromatium, Thiophysa, Thiosphaerella, Thiovulum |
| CHLAMYDOBACTERIALES. Нитчатые бактерии. Гетеротрофы. Многие способны откладывать в слизистых чехлах (влагалищах) гидраты окиси железа. Растут в виде нитей. Молодые клетки, выходящие из чехла, подвижны, обладают полярным и субтерминальным жгутиками | Chlamydobacteriaceae. Растут в виде нитей, покрытых слизистой капсулой. Гетеротрофы. Аэробы | Sphaerotilus, Leptotrix, Crenotrix, Thiothrix |
| CARYOPHANALES. Многоклеточные нитчатые (трихомные) бактерии. Сходны с синезелеными водорослями (цианобактериями), но бесцветны. Нити подвижные и неподвижные. Некоторые виды образуют эндогенные споры | 1. Oscillospiraceae. Образуют споры. Трихомы различной длины, состоят из дисковидных клеток. Подвижны, жгутпкование перитрихиальное. Анаэробы | Oscillospira |
| 2. Caryophanaceae. Спор не образуют. Трихомы часто подвижны | Caryophanon | |
| 3. Arthromitaceae. Трихомы состоят из цилиндрических клеток. Неподвижны. Споры образуются на дисталъных концах трихомов | Arthromitus, Simonsiella | |
| 4. Pontotricaceae. Трихомы неподвижны, состоят из цилиндрических клеток. Размножаются гормогониями и одноклеточными гонидиями | Pontothrix | |
| ACTINOMYCETALES. Прокариотные микроорганизмы, клетки которых способны к ветвлению и образованию мицелия. Подвижных клеток не образуют. Очень широко распространены в природе | 1. Actinomycetaceae. Типичные представители актиномицетов с хорошо развитым мицелием. Споры формируются путем одновременного расчленения спороносцев на длинные цепочки спор | Actinomyces, Proactinomyces, Chainia, Actmopicnidium |
| 2. Micromonosporaceae. Актиномицеты с хорошо развитым мицелием. Споры формируются путем последовательного отчленения кончика спороносна. Число спор небольшое | Micromonospora, Microbispora, Micropolyspora, Actinobifida, Promicromonospora | |
| 3. Streptosporangiaceae. Актиномицеты с хорошо развитым мицелием. Образуют спорангии, в которых формируются множественные споры | Streptosporangium, Micrcsporangium, Amorphosporangium, Elytrosporangium, Actinosporangium, Intrasporangium | |
| MYCOBACTERIALES. Бактерии, не образующие мицелия. Клетки палочковидные, способны ветвиться. Спор не образуют. Размножаются простым делением или дроблением | Mycobacteriaceae Характеристика та же, что и для порядка | Mycobacterium, Mycococcus, Propionibacterium, Lactobacterium, Pseudobacterium |
| COCCALES. Бактерии с кокковидпыми клетками различных размеров и неправильной конфигурацией. Неподвижные. Спор не образуют. Размножаются делением, перешнуровыванием и почкованием | Соссасеае. Характеристика та же, что и для порядка | Micrococcus, Nitrosococcus, Diplococcus, Neisseria, Streptococcus, Sarcina, Peptostreptococcus, Pediococcus, Leuconostoc, Staphylococcus, Gaffkya, Methanococcus, Peptococcus, Veillonella, Aerococcus |
| ACTINOPLANALES. Прокариотные микроорганизмы, клетки которых способны ветвиться и образовывать мицелий. В процессе развития образуются подвижные клетки - споры или фрагменты нитей мицелия | 1. Actinoplanaceae. Актиномицеты, образующие хорошо оформленные спорангии. Внутри спорангиев формируются подвижные споры | Actinoplanes, Spirillospora, Ampullariella, Pilimelia, Kitasatoa |
| 2. Dermatophilaceae. Актиномицеты, формирующие подвижные споры путем дробления нитей мицелия. Образуемые скопления спор имеют неопределенную форму, без резких очертаний | Dermatophilus, Proactinoplanes | |
| 3. Planosporaceae. Актиномицеты, формирующие подвижные споры на коротких спороносцах воздушного мицелия. Споры покрываются слизистой капсулой, имитирующей оболочку сумки. Однако спорангии, как таковые, отсутствуют | Planospora, Planobispora, Sporichtia, Dactylosporangium | |
| MYXOBACTERIALES. Грамотрицательные бактерии. Клетки гибкие, способны к скользящему движению в слизи. Многие образуют слизистые колонии и плодовые тела | 1. Promyxobaeteriaceae. Не образуют плодовых тел. Образуют либо не образуют микроцист. Активно разлагают клетчатку | Cytopliaga, Sporocytophaga, Flexibacter |
| 2. Archangiaceae. Колонии не имеют правильной формы. Нет оформленных цист | Archangium, Stelangium | |
| 3. Sorangiaceae. Цисты угловатые, собраны в кучу, окруженную общей оболочкой | Sorangium | |
| 4. Polyangiaceae. Оформленные цисты с четкими оболочками. Плодовые тела пигментированы, ветвятся | Polyangium, Synangium, Меlittangium, Podangium, Chondromyces | |
| 5. Myxococcaceae. Палочковидные клетки укорачиваются в цистах, образуют споры | Myxococcus, Chondrococcus, Angiococcus | |
| SPIROCHAETALES. Клетки спирально извиты, змеевидно подвижны, обладают осевой плотной нитью, вокруг которой закручена клетка | Spirochaetaceae. Включает 6 родов, различающихся морфологически, по размерам клетки (мелкиклетки Spirochaeta, гигантские - Cristispiга). Есть паразиты (Borrelia) | Spirochaeta, Saprospira, Cristispira, Borrelia, Treponema, Leptospira |
| MYCOPLASMATALES. Клетки разнородны по форме, размерам, не имеют клеточных стенок. Гетеротрофы. Паразиты и сапрофиты | 1. Mycoplasmataceae. Микоплазмы, не нуждающиеся в стерине | Mycoplasma, Thermomycoplasma |
| 2. Acholeplasmataceae. Стеринзавпсимые микоплазмы | Acholeplasma | |
| Rickettsiales. Мелкие палочковидные и кокковидные грамотрицательные бактерии. Не растут на средах. Облигатные внутриклеточные паразиты, возбудители болезней человека и животных. Аэробы, содержат цитохромы. | 1. Rickettsiaceae. Типичные представители порядка. Паразитируют в клетках тканей животных и растений | Rickettsia, Dermacentroxenus, Coxiella |
| 2. Ehrlichiaceae. Паразитируют в лейкоцитах | Ehrlichia, Cytoecetes | |
| 3. Bartonellaceae. Паразитируют в эритроцитах | Bartouella, Eperythrozoon, Haemobartolpnella, Grahamella | |
| CHLAMYDIALES. Облигатные энергетические паразиты, не способные генерировать АТФ. Анаэробы, не содержат цитохромов. Характеризуются сложным циклом развития | Chlamydiaceae. Характеристика та же, что и для порядка | Chlamydia |
Класс Actinomycetes (актиномицеты) состоит из организмов, обладающих мицелиальными, нитевидными, палочковидными и кокковидны-ми грамположительными клетками. В отличие от бактерий, входящих в другие классы, для типичных представителей актиномицетов (высшие формы) характерно наличие хорошо выраженного ветвящегося септированного или не-септированного мицелия.
Имеются и переходные к типичным актиноми-цетам низшие формы — микобактерии, мико-кокки и микрококки, для которых характерны ветвление на ранних стадиях развития, образование боковых выростов — рудиментов веток.
Класс актиномицетов подразделяется на порядки: Actinomycetales (актиномицеты, не образующие подвижных клеток), Actinoplanales (актиномицеты с подвижными клетками), Мусоbacteriales (микобактерии) и Coccales (кокки).
Класс Myxobacteriae (миксобактерии). Организмы этого класса представлены палочковидными и кокковидными клетками, обладающими, тонкой эластичной (неригидной) клеточной стенкой, благодаря чему они при движении могут изменять свою форму, изгибаться. Жгутиками не обладают. Движение осуществляется по типу скольжения. Миксобактерии способны образовывать микроцисты, а также особые плодовые тела, имеющие самую различную форму.
В класс миксобактерии входит один порядок — Myxobacteriales.
Порядок эубактерии (EUBACTERIALES)
В строгом смысле к истинным бактериям относят одноклеточных бактерий с ригидными клеточными стенками, гетеротрофов, перемещающихся (если обладают подвижностью) с помощью жгутиков. В эту группу входит преобладающее количество прокариотных микроорганизмов.
Клетки эубактерий очень малы и вместе с тем сильно различаются по размерам: от карликовых форм (диаметром около 0,125 мкм) до гигантов, длиной до 10 мкм (Ghromatium okenii). В природных субстратах (илах, почвах) можно встретить стебельковых бактерий, достигающих в длину вместе со стебельком 100 мкм и более. Следовательно, гиганты превышают карликов по размерам в 100 и 1000 раз. Большинство палочковидных бактерий по длине не превышают 5 мкм, по толщине 1 мкм. У многих псевдомонад диаметр клетки равен 0,4—0,7 мкм, у ряда почвенных форм — 0,2—0,3 мкм.
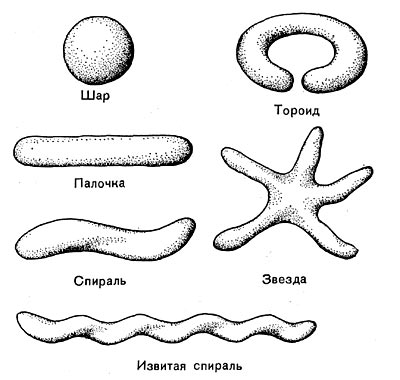
Рис. 14. Основные формы бактериальных клеток. Схема.
Разнообразие форм бактериальных клеток невелико. Основные формы бактерий — это шары (кокки), палочки (прямые, изогнутые или извитые), тороиды и звезды (рис. 14). Клетки многих видов неспорообразующих и спорооб-разующих бактерий выглядят как палочки. Спириллы имеют форму спирали, и ряд близких видов — форму тороида.
Поверхность клеток бактерий имеет часто придаточные структуры. Наиболее распространенными являются жгутики и ворсинки (фимбрии, нитевидные придатки клеток).
Фимбрии (или ворсинки) короче и тоньше жгутиков, имеют вид жестких прямых нитей и, покрывая всю клетку, создают ворсистую поверхность (рис. 15, 16). Длина фимбрий от 0,3—4 мкм, ширина — 0,01 мкм. Иногда они сливаются в комки, придавая неопрятный вид клетке; в других случаях поверхность клеток покрыта войлокообразным чехлом, состоящим из сплетений тонких нитей. Наряду с фимбриями можно видеть капсульный материал, как бы застрявший между нитями фимбрий, выполняющих роль арматуры. Нередко можно встретить лентовидные придатки у клеток. В среде обитания фимбрий выполняют прикрепительные функции, обеспечивая прикрепление клеток к частицам почвы, органических остатков, объединение клеток в группы (рис. 16). Есть сведения о том, что по коротким нитям, соединяющим две клетки и имеющим внутри канал, происходит обмен наследственной информацией. Среди побочных функций фимбрий — защита клетки от нападения паразитов, так как успех атаки паразитов обеспечивается непосредственным контактом с поверхностью клетки хозяина.
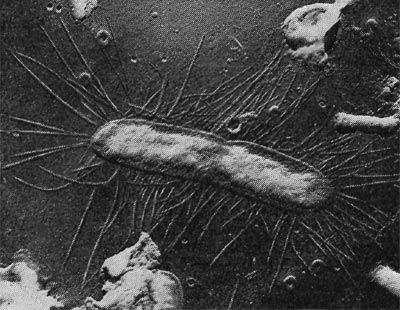
Рис. 15. Палочковидная бактерия с фимбриями. Увел. X 15 000.
Изучение химической природы ворсинок встретилось со значительными трудностями, так как потребовалось их отделить от клетки, «побрить» клетку. К счастью, для исследователей это оказалось возможным проделать в дезинтеграторах — приборах, разрушающих клетки. При этом ворсинки обрываются, после чего их отделяют на центрифугах и накапливают. Как оказалось, они состоят из белка, обладают гидрофобностью (водоотталкивающими свойствами) и локализованы на клеточной стенке, представляя собой как бы «взлохмаченную» стенку клеток.
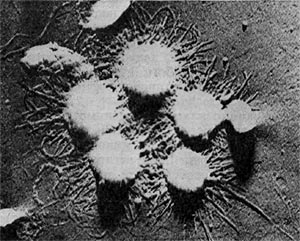
Рис. 16. Кокки с фимбриями. Увел. X 12000.
Другим типом придатков, свойственным многим бактериям, являются жгутики. По структуре они представляют собой гомогенную белковую нить или плотно свернутую косу из 2—3 нитей. Длина жгутиков 3—12 мкм, толщина — 0,02 мкм. Жгутики волнообразно изогнуты и могут быть расположены по всей поверхности клетки (перитрихиально) либо на полюсах (монотрихиально). Они составляют до 2% сухой массы бактерии. Жгутики являются органом движения бактерий, хотя известны случаи существования бездействующих (парализованных) жгутиков. Прикрепление жгутиков к клетке связано с цитоплазматической мембраной (рис. 17, 18). Основание жгутика прикреплено к специальной мембране. При делении у монотрихов дочерняя клетка приобретает полярный жгутик в том месте, где завершилось деление (рис. 19,7). В случае перитри-хиального жгутикования новые и ранее существовавшие жгутики распределяются равномерно (рис. 19,2).
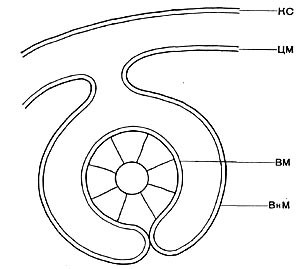
Рис. 17. Схема структуры зоны прикрепления жгутика в клетке бактерии: КС — клеточная стенка; ЦМ — цитоплазматическая мембрана; ВМ — внутренняя мембрана прикрепительного тельца жгутика; ВнМ — внешняя мембрана прикрепительного тельца (по Таушель и др.).
У многих микроорганизмов жесткая клеточная стенка окружена слоями слизистого материала, образующего капсулы разной плотности и толщины (рис. 20). Основными компонентами капсул являются вода и полимеры — полисахариды. Особенно обильное образование слизи наблюдается у многих микроорганизмов в тех случаях, когда среда содержит сахарозу. Молочнокислая бактерия Leuconostoc mesen-teroides за несколько часов превращает раствор в студень — декстран, который используют как заменитель крови, для повышения вязкости водных растворов. Препарат из декстрана — сефадекс — применяется в лабораториях в качестве «молекулярного сита» для разделения веществ с большой молекулярной массой.
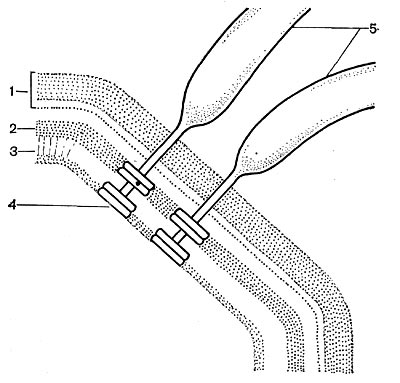
Рис. 18. Схема прикрепления жгутика: 1 — клеточная стенка; 2 — цитоплазматическая мембрана; 3 — мембрана жгутиков; 4 — диски основания жгутиков; 5 — жгутики (по Броку, 1970).
Основным структурным компонентом клетки бактерий является клеточная стенка, которая придает протопласту микроба характерную для него форму. Когда целостность стенки нарушается, образуется сферический протопласт (при участии внутриклеточного осмотического давления, достигающего 20—50 атм и более). Клеточная стенка составляет от 10 до 50% сухой массы бактерии. Количество материала клеточной стенки увеличивается с возрастом.
Таблица. Сопоставление признаков прокариотных и эукариотных организмов
Исследования последнего десятилетия по биохимии клеточной стенки бактерий являются крупнейшими достижениями современной микробиологии, позволившими понять молекулярную организацию микробной стенки. Как уже упоминалось ранее, в зависимости от строения клеточной стенки эубактерии разделяются на 2 группы — грамположительные и грамотрицательные. В стенках грамположи-тельных бактерий очень высокое содержание гликопептидов (95% от суммы веществ стенки), однако их строение более простое, чем стенок грамотрицательных бактерий. В стенках грам-отрицательных бактерий лишь 5% гликопептидов. Этот слой покрыт рыхлым слоем белка, который, в свою очередь, прикрыт липополиса-харидным и липопротеидным слоями, пронизанными каналами (рис. 21 и 6).
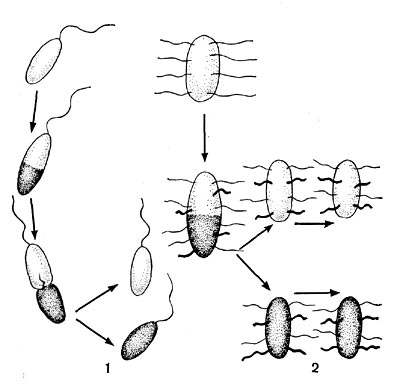
Рис. 19. Распределение и образование жгутиков во время деления клеток: 1 — организм с полярным жгутиком, 2 — перитрих. Схема.
Муреиновый мешок выполняет у бактерий роль опорного каркаса. У грамположительных бактерий он многослоен, у грамотрицательных — однослоен. По существу дела, этот слой представляет собой одну молекулу, покрывающую бактериальную клетку.
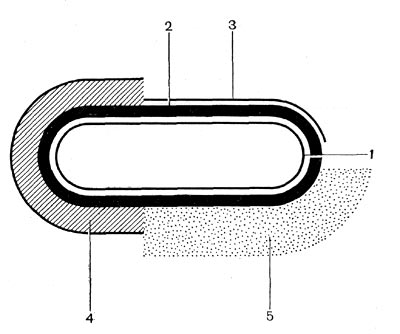
Рис. 20. Схема взаиморасположения внешних слоев клетки бактерий: 1 — цитоплазматическая мембрана, 2 — клеточная стенка, 3 — микрокапсула, 4 — капсула, 5 — слизистый слой.
Все описанные здесь особенности прокари-отных организмов являются исключительно своеобразными, свойственными представителям этого удивительного мира микроскопических существ. Внешний вид и функционально аналогичные органы (жгутики, реснички и др.) оказываются иными у эукариотных клеток.
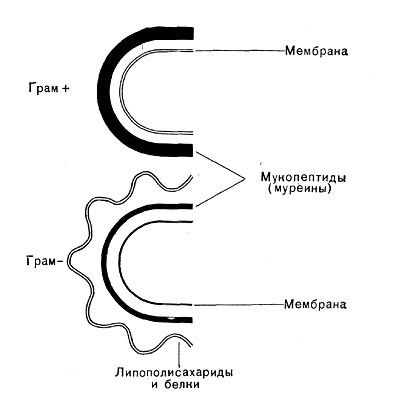
Рис. 21. Схема строения клеточных стенок грамположительных (Грам+) и грамотрицательных (Грам -) — бактерий.
Уникальны также структура и состав клеточных стенок бактерий. Структурные элементы стенок представляют ахиллесову пяту бактерий, так как некоторые лекарственные препараты действуют только на стенки бактерий, не затрагивая эукариотных клеток высших организмов.
Многие победы современной медицины основаны на специфичности клеточных стенок наших друзей и врагов — прокариотов.
Большие различия между эукариотами и прокариотами обнаруживаются и в мембранном аппарате клеток (в химическом составе и структуре). Так, например, у бактерий нет истинных митохондрий, играющих роль энергетических депо клеток. Их функции выполняют простые мембранные структуры (мезосомы). Особенности питания, транспорт веществ через стенку, богатейший спектр веществ, синтезируемых бактериями, особенности дифференцировки клеток, большая скорость размножения и адаптации к среде делают прокариотов истинными хозяевами и вершителями процессов круговорота веществ в биосфере.
Сопоставление некоторых свойств прокариотных и эукариотных организмов приведено в таблице на стр. 208.
Семейство псевдомонады (PSEUDOMONADACEAE)
Типичными представителями эубактерии являются грамотрицательные неспороносные бактерии, объединяемые в семейство Pseudomo-nadaceae. Название семейства происходит от двух греческих корней: «псевдо» — сходный и «монас» — название группы простейших (животных) с полярно расположенными жгутиками. Поэтому к псевдомонадам относят как палочковидные бактерии с полярно расположенным жгутиком, так и слабоизогнутые палочки, физиологически крайне специализированные ав-тотрофные хемосинтезирующие бактерии (Нуdrogenomonas, Nitrosomonas, Thiobacillus) и обычные гетеротрофные бактерии (Pseudomonas), т. е. смешиваются представители питания — автотрофного и гетеротрофного.
Следовательно, в семейство Pseudomonada-сеае входят грамотрицательные палочки, растущие в аэробных условиях или получающие энергию за счет анаэробного дыхания либо за счет связанного кислорода (денитрификация), но не брожения. Псевдомонады используют широкий спектр органических веществ, в том числе циклических соединений (гетероциклических и ароматических). Благодаря «всеядности» псевдомонады распространены повсеместно: в воде, почве, илах, переносятся с током воздуха. Многие из них образуют водорастворимые и флюоресцирующие пигменты.
Патогенность у псевдомонад выражена слабо, но даже такой обычно хорошо знакомый микробиологам сапрофит, как Pseudomonas aerugi-nosa, часто является возбудителем вторичной инфекции долго не заживающих ран и язв у человека и животных. Пигменты, выделяемые этим микробом, придают гною сине-зеленую окраску. Вспышки энтерита у новорожденных вызываются этой бактерией. Она же вызывает заболевания растений (табак и салат) и смертельные заболевания домашней птицы. Представители другого рода (объединяет 65 видов) — Xanthomonas — наносят большой вред сельскому хозяйству, деревообрабатывающей и другим видам промышленности, где используется растительное сырье. Они вырабатывают ферменты, которые разрушают протопектины — вещества, цементирующие клетки растений. Этот процесс приводит к ослизнению растительной массы, а растение — к гибели.
Род псевдомодас (PSEUDOMONAS)
Бактерии этого рода широко используются в хозяйственной практике, а также в качестве моделей для многочисленных теоретических исследований, поэтому мы и остановимся на этих микроорганизмах подробнее.
В 50—60-х годах нашего столетия в мировой и отечественной литературе появилось большое количество научных исследований о бактериях рода Pseudomonas, в частности об их флуоресцирующей группе. Эти исследования касаются вопросов использования флуоресцирующих бактерий для решения ряда практических и теоретических задач. Существует много патентов и научно-исследовательских работ американских, японских и советских авторов, где подробно представлены характеристики продуцентов, состав сред для выращивания бактерий и описаны условия культивирования для получения значительных количеств различных биологически активных соединений.
Так, при использовании в качестве продуцентов некоторых штаммов бактерий Ps. fluorescens осуществляется биосинтез органических кислот: глюконовой, 2-кетоглюконовой, а-кетоглутаровой и пировиноградной. Для получения аминокислот: глутаминовой, l - аспарагиновой, валина и метионина — также используются различные представители бактерий Pseudomonas fluorescens и Ps. aeruginosa.
Из окрашенных веществ, синтезируемых бактериями рода Pseudomonas, были выделены химические вещества, обладающие антибиотическими свойствами, — пиоцианин, хлоро-рафин, оксихлорорафин, феназин-1-карбоновая кислота и эругинозин. Все перечисленные пигменты обладают антибиотической активностью против грамположительных и грамотрицатель-ных бактерий, дрожжей и грибов.
Кроме антибиотиков, в состав окрашенных веществ, синтезируемых псевдомонадами, входят витамины. Советские и зарубежные исследователи еще в 30-х годах нашего столетия отмечали, что в состав желто-зеленого флуоресцирующего пигмента, синтезируемого псевдомонадами, входят рибофлавин, фолиевая кислота, птерин. Использование современных методов исследования позволило выделить в кристаллически чистом виде и определить составные части витаминов птеридинового и каротиноид-ного типов, образуемых псевдомонадами.
В работах советских и зарубежных исследователей последнего десятилетия отмечается, что флуоресцирующие псевдомонады могут быть продуцентами ферментов. Так, советские исследователи изучают процесс синтеза фермента аспарагиназы, используя Ps. fluorescens. Ac-парагиназа обладает канцеростатическими действиями. В ФРГ организовано производство фермента пероксидазы. В качестве продуцента пероксидазы также используют бактерии Ps. fluorescens.
В практике контроля пищевых продуктов флуоресцирующие псевдомонады издавна известны как индикаторы на зараженность.
Интенсивное развитие бактерий на пищевых продуктах сопровождается выделением флуоресцирующего пигмента. Этот признак применяется при отбраковке пищевых продуктов.
Решение ряда теоретических вопросов осуществляется с помощью модельных опытов с бактериями рода Pseudomonas: изучаются некоторые пути углеводного и аминокислотного обмена, отдельные этапы процесса дыхания микроорганизмов.
Японские и американские исследователи использовали псевдомонады для получения кристаллического цитохрома и изучения его аминокислотного состава.
Бактерии рода Pseudomonas широко распространены в природе. Их можно встретить в воздухе, почве, морских и пресных водоемах, сточных водах и иле, нефти и на газовых месторождениях. Псевдомонады были обнаружены на пищевых продуктах, телах животных, растениях, а также в гнойных ранах и экскрементах больных млекопитающих.
Интерес к этой группе бактерий все больше возрастает. Кроме микробиологов, фитопатологов и медицинских бактериологов, псевдомонады привлекают внимание также и ученых других профилей: лимнологов, почвоведов и т. д.
По Красильникову, бактерии рода Pseudomonas монолитны по морфологическим и очень разнообразны по культуральным и физиологическим признакам.
Клетки псевдомонад представляют собой мелкие одиночные грамотрицательные палочки. Спор и выростов не образуют, подвижны, имеют полярно расположенные жгутики. Число жгутиков у разных видов колеблется. Клетки в культурах часто объединяются в небольшие комочки или зерна, окруженные толстой слизистой оболочкой, иногда резко очерченной, — зооглеи.
К настоящему времени накопилось достаточно сведений, чтобы использовать некоторые биохимические признаки для таксономической характеристики рода. Так, например, химический состав клеточной стенки бактерий постоянен и, как правило, не изменяется на различных стадиях развития культуры или при возникновении мутаций. У бактерий рода Pseudomonas процент Г + Ц (гуанин + цитозин) в ДНК колеблется в пределах 58—69%.
Колонии бактерий очень разнообразны: слизистые и пастообразные, выпуклые и плоские, крупные и мелкие. У многих видов отмечается внутренняя структура колоний. Если их рассматривать в микроскопе при малом увеличении, то в одних случаях можно обнаружить мелкозернистую колонию; в других — ячеистую, напоминающую соты; в третьих — колонии в виде мелких комочков или зерен. Большинство видов имеет колонии без внутренней структуры — под микроскопом они выглядят как однородная гомогенная масса. Псевдомонады хорошо растут на обычных питательных средах — сложных органических.
Культуры различаются между собой способностью разлагать белки, использовать углевод, расщеплять крахмал, клетчатку, углеводороды, соединения ароматического ряда и другие сложные по составу вещества.
Большинство бактерий рода Pseudomonas обладает гетеротрофным типом обмена веществ, т. е. для построения тела им требуется готовое органическое вещество. Биосинтетические процессы, при этом осуществляются за счет обмена окислительного типа, где кислород является конечным акцептором электронов, перенос которых связан с системой цитохромов. Некоторые представители этого рода могут существовать за счет анаэробного нитратного дыхания, другие используют энергию окисления водорода. Многие виды псевдомонад образуют пигменты, различные по окраске и химической природе; некоторые синтезируют витамины, антибиотики, токсины.
Среди представителей бактерий рода Pseudomonas есть формы, токсичные для животных организмов (патогенные бактерии). Имеется также немало фитопатогенных видов, поражающих растения.
Характеристика отдельных видов и групп бактерий рода Pseudomonas
В «Определителе бактерий и актиномицетов» (1949) Н. А. Красильникова описано более 200 видов бактерий рода Pseudomonas. Это наиболее полное и пока единственное систематическое описание, где представлены характеристики почти всех известных псевдомонад, которые распределены между собой в зависимости от характера своих признаков.
Для разделения этих бактерий на виды использован легко наблюдаемый признак пигментации, а также морфологические, культу-ральные и некоторые физиологические свойства. Особенно отмечен признак токсичности бактерий по отношению к животным и растительным организмам.
Ps. aeruginosa — классический представитель рода Pseudomonas. Различные штаммы этих бактерий можно обнаружить всюду: в почве, воде, воздухе, гнойных ранах и сточных водах. По сравнению с другими видами псевдомонад эти формы наиболее интенсивно исследуются бактериологами, изучающими патогенную группу, и фитопатологами. Бактерии Ps. aeruginosa обладают особым разнообразием свойств, но в то же время у них отмечаются характерные общевидовые морфологические и физиологические признаки. Клетки бактерий представляют собой мелкие палочки (1,0 — 1,5 х 0,5мкм), одиночные или соединенные в пары; имеют один-два, редко три полярно расположенных жгутика, грамотрицательные. Культуры образуют синий флуоресцирующий пигмент, в состав которого входят пиоцианин. Бактерии желатин разжижают, молоко не свертывают, не пептонизируют, нитраты восстанавливают до нитритов, используют углеводы с образованием кислоты; аэробы. Температурный оптимум развития около 37 °С. Окисляют глюконат, образуя слизь. Являются сильными окислителями углеводов (сахаров, органических кислот, углеводородов). Среди этих бактерий встречаются подвижные и неподвижные формы. Многие культуры синтезируют окрашенные соединения различных типов, хорошо проникающие в субстрат. В состав пигментов входят соединения феназинового и пгеридинового ряда, а также флуоресцирующие сине-зеленые и желто-зеленые вещества.
Качественный состав пигментов и их количественный набор зависят от условий культивирования, немалое значение имеет и экологический фактор.
К этому виду близко примыкают бактерии Ps. schuilkilliensis, которые синтезируют сине-зеленый флуоресцирующий пигмент, диффундирующий в субстрат; температурный оптимум развития около 37 °С. Желатин разжижают медленно.
Культуры Ps. syncyanea образуют сине-зеленый флуоресцирующий пигмент. Желатин не разжижают, нитраты не восстанавливают; аэробы. Температурный оптимум развития около 25 °С.
Ps. scissa. Клетки мелкие (1,0x0,3 мкм), подвижные. Бактерии образуют желто-зеленый флуоресцирующий пигмент. Желатин не разжижают, молоко не изменяют, нитраты восстанавливают до нитритов; аэробы. Оптимум температуры роста около 27 °С. Эти псевдомонады были выделены из воды и почвы. К виду относятся 6 различных штаммов бактерий, обладающих сходными свойствам-и.
Ps. atlantica. Клетки мелкие, подвижные, с полярным жгутиком; колонии гладкие, блестящие. Культура энергично разжижает агар-агар и желатин, молоко пептонизирует, крахмал разлагает, нитраты не восстанавливает. Бактерии относятся к аэробам. Оптимальная температура роста около 25 °С. Эти псевдомонады были выделены из морской воды (Атлантический океан).
Ps. fluorescens. Мелкие палочки (1 —2 X 6 мкм), подвижные, имеют 2—4 полярных жгутика. Бактерии грамотрицательные. Культуры бактерий образуют зеленовато-желтый флуоресцирующий пигмент, который проникает в субстрат. Представители этого вида не синтезируют пиоцианин; хорошо развиваются на органических и синтетических средах. Колонии бесцветные или белые, выпуклые, гладкие, блестящие. Характерной особенностью этого вида является внешняя микроструктура колоний: при малом увеличении микроскопа поверхность колоний имеет характерное сетчатое или ячеистое строение. В бульоне бактерии образуют муть и пленку. Желатин разжижают, молоко не свертывают, нитраты восстанавливают до нитритов, образуют кислоту на глюкозе и сахарозе; аэробы. Оптимальная температура роста около 25 °С. Бактерии часто встречаются в воде, почве, на разных растительных и животных субстратах; не патогенны для животных.
Особое место занимает вид Ps, aurantiaса. Описание морфологических, культураль-ных и некоторых физиологических свойств бактерий этого вида встречается в основном в работах советских исследователей. Клетки бактерий этого вида палочковидные, 2—3 х 0,6 мкм, подвижные, имеют на конце 2—5 жгутиков. Колонии на питательных средах окрашены в оранжевый или красно-желтый цвет, гладкие, блестящие, плоские или выпуклые. Пигмент диффундирует в субстрат. Культуры хорошо растут на обычных питательных средах; желатин разжижают, молоко пептони-зируют. Кислоту образуют при росте на глюкозе, сахарозе, манните, глицерине. Нитраты не восстанавливают, крахмал не разлагают, аэробы. Оптимальная температура роста около 25 °С. В состав оранжевого пигмента входит несколько веществ различной химической природы.
Морфологические, культуральные и физиолого-биохимические признаки псевдомонад
В последнее десятилетие появились фундаментальные исследования, касающиеся таксономической характеристики отдельных групп и видов бактерий рода Pseudomonas. В этих работах подробно описываются различные морфологические, культуральные и физио-лого-биохимические признаки некоторых групп, видов или отдельных представителей бактерий этого рода. Японские исследователи И и ц у -ка и Ком агата (1963) в своей монографии представили таксономическую характеристику 202 штаммов, относящихся к 28 видам псевдомонад. Эти бактерии были разделены на три группы на основании характеристики образуемых ими пигментов.
Флуоресцирующие бактерии.
Эта группа объединяет представителей 12 видев бактерий.Все они синтезируют водорастворимые флуоресцирующие пигменты от желто-зеленого до оранжевого оттенка. Некоторые из них образуют синий пигмент, нерастворимый в воде. Бактерии этой группы активно разлагают углеводы. При росте на средах с гексозами образуют кислоты; на средах с лактозой и крахмалом не развиваются. Потребляют органические кислоты, растут на средах с ароматическими соединениями; аэробы. Восстанавливают нитраты до нитритов. Сероводород и индол не образуют. Распространены в воде, почве, сточных водах.
Ахромогенные бактерии.
В эту группу входят бактерии, которые не синтезируют пигментов. Используют сахара, органические кислоты. Восстанавливают нитраты до нитритов. Сероводород и индол не образуют. Выделены из пищевых продуктов (пива, мяса).
Хромогенные бактерии.
Эта группа объединяет бактерии 6 видов. Фитопатогенных форм среди них нет. Все бактерии образуют желтый пигмент, нерастворимый в воде; аэробы. Восстанавливают и потребляют нитраты. Гидроли-зуют крахмал. Образуют сероводород и индол. Выделены из почвы.
Японские авторы отмечают, что результаты, полученные при сравнении способности использовать различные углеродные соединения, подтверждают правильность разделения бактерий рода Pseudomonas на три группы по признакам пигментации. Все штаммы, отнесенные к флуоресцирующей группе, имеют общие свойства: подкисляют среду при использовании глюкозы, потребляют глюконат, разлагают ароматические соединения, обладают высокой активностью фермента цитохромоксидазы. Всех этих свойств у бактерий, отнесенных к ахро-могенной и хромогенной группам, обнаружено не было. Следовательно, существует явная корреляция между характером углеводного обмена бактерий рода Pseudomonas и их пигментацией.
Американские ученые Станиер с сотрудниками (1966) представили фундаментальное исследование по таксономии бактерий рода Pseudomonas, положив в его основу физиолого-биохимические свойства этих бактерий. Было изучено 267 штаммов, принадлежащих к 10 видам. Значительная часть таксономических данных была получена путем применения метода, предложенного Дюреном де Ионгом (1926), который заключался в детальном изучении пищевых потребностей у большого количества бактерий. У каждого штамма изучали способность использовать в качестве единственного источника углерода и энергии 146 органических соединений. Были изучены углеводы, жирные кислоты, органические кислоты, спирты, ароматические соединения, не содержащие азота в кольце, а также углеводороды.
Кроме того, исследовались: потребность бактерий в источниках азота, ростовых факторах, способность к денрпрификации и другие физио-лого-биохимические признаки.
Цитологические наблюдения включали исследования размера клеток, характера жгути-кования, окраску по Граму, образование включений и т. п.
Полученные данные позволили разделить бактерии рода Pseudomonas на три группы: флуоресцирующую, кислотоиспользующую и щелочеобразующую.
В группу флуоресцирующих бактерий включены бактерии, относящиеся в основном к трем видам (Ps. aeruginosa, Ps. fluorescens, Ps. putida), и несколько представителей других видов. Все они синтезируют водорастворимый желто-зеленый флуоресцирующий пигмент, используют нитраты или соли аммония как источники азота, не образуют поли-в-масляную кислоту в качестве резервного материала в клетках.
Эта группа бактерий делится на семь различных биотипов в зависимости от некоторых специфических признаков: способности синтезировать пигменты феназинового типа, образовывать леван из сахарозы, а также по наличию сильных денитрифицирующих свойств.
Кислотоиспользующие бактерии не синтезируют пигментов; они аэробы, лофотрихи. Все образуют в клетках поли-в-оксимасляную кислоту в качестве резервного материала. Кроме этих признаков, описаны некоторые другие свойства, характерные для определенных штаммов, а не для групп бактерий.
В щелочеобразующую группу входит всего 7 представителей. Все эти бактерии бесцветные, аэробы, с монотрихиальным жгутикованием. Они лучше всего растут при температуре 41 °С. Такие бактерии обладают способностью к дени-трификации.
Бактерии рода Pseudomonas интенсивно изучаются и их характеристика непрерывно обновляется и дополняется.
Обобщая некоторые сведения, накопленные к настоящему времени по таксономической характеристике бактерий рода Pseudomonas, можно отметить, что многие исследователи, пытаясь объединить свои данные по характеристике бактерий и изложить их в определенном таксономическом порядке, не всегда приходят к единому мнению. Это объясняется прежде всего тем, что к настоящему времени накоплено еще мало единых, научно обоснованных данных по оценке тех или иных свойств бактерий рода Pseudomonas.
Пигментация бактерий рода Pseudomonas
Изучение химического состава и природы пигментов, синтезируемых микроорганизмами, получило в настоящее время широкое распространение. Это объясняется тем, что пигменты одновременно могут быть физиологически активными веществами (антибиотиками, ферментами, витаминами, фитонцидами, стимуляторами роста), и также тем, что пигментация микроорганизмов в сочетании с другими физиологическими признаками может быть важным дополнением при систематике микроорганизмов.
Началом биологического подхода к изучению пигментов и некоторых вопросов их образования в клетке можно считать работы советских исследователей школы Н. А. Красильникова. Они установили, что у пигментных форм микроорганизмов существует коррелятивная зависимость между качественным составом пигмента и другими физиологическими признаками. Это касается красно-оранжевой группы актиномицетов, проактиномицетов и микобак-терий, а также зеленых, синих и желтых групп актиномицетов.
Культуры бактерий рода Pseudomonas иногда утрачивают способность синтезировать пигмент. Например, некоторыэ бактерии Ps. aeruginosa могут временно или совсем утратить пигментацию. Известны и беспигментные штаммы этого вида.
Цвет окрашенных соединений, синтезируемых псевдомонадами, различен. Он может быть синим, сине-зеленым, желто-зеленым, желтым, оранжевым, красным, фиолетовым, коричневым и черным. Среди этих соединений есть растворимые и нерастворимые в воде вещества. Их синтез может происходить внеклеточно, а также внутриклеточно с накоплением в клетке и с последующим выходом из нее.
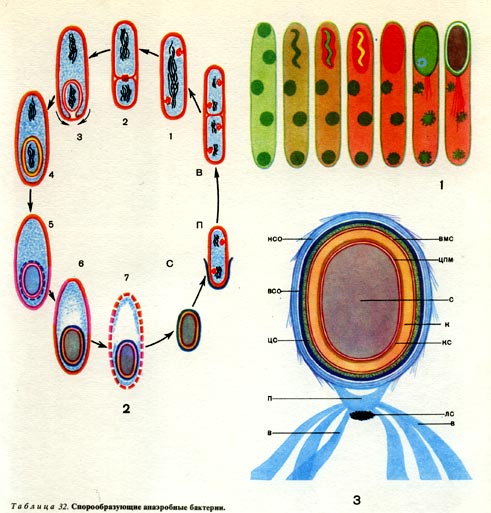
Таблица 32. Спорообразующие анаэробные бактерии.
Как правило, определенные виды псевдомонад одновременно образуют комплекс пигментов различных типов, качественный и количественный состав которых подвержен изменениям и зависит от компонентов среды, условий культивирования (аэрация, освещенность, рН и т. д.), индивидуальных особенностей бактериальных штаммов и источников выделения (экологии бактерий).
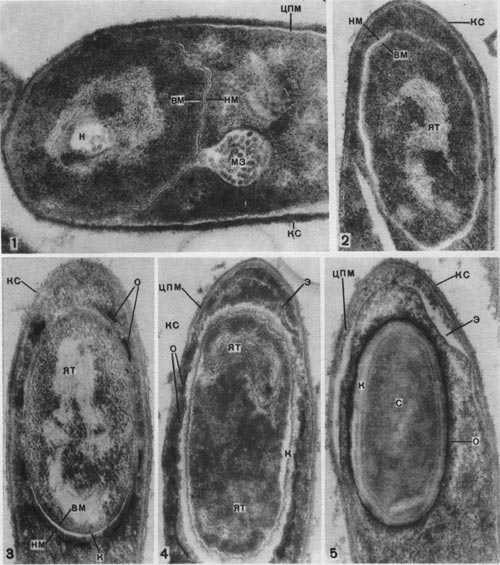
Таблица 33. Спорообразование у анаэробных бактерий: 1 — Clostridium sporotrichum, инвагинация мембраны и образование септы в начале спорообразования: цпм — цитоплазматическая мембрана; вм—внутренняя мембрана проспоры; нм — наружная мембрана проспоры; мз—мезосомы; н — нуклеоид; м — инвагинирующие мембраны; 2 — Cl. sporofasciens, образование проспоры, окруженной двумя мембранами: нм — наружная мембрана проспоры; ем — внутренняя мембрана проспоры; кс — клеточная стенка; ят — ядерный тяж; 3 — Cl. sporotrichum, начало закладки споровой оболочки: о — листки оболочки; нм — наружная мембрана проспоры; ят — ядерный тяж; кс — клеточная стенка; ем — внутренняя мембрана проспоры; к — кортекс; 4 — Cl. penicfflum, нуклеоид в проспоре: о — оболочка проспоры; к — кортекс; э — экзоспориум; цпм — цитоплазматическая мембрана; ят— ядерный тяж; кс — клеточная стенка материнской клетки; 5 — Cl. penicillum, завершение образования споровой оболочки, созревание сердцевины: кс — клеточная стенка материнской клетки; о — оболочка; э — экзоспориум; цпм — цитоплазматическая мембрана; к — кортекс; с — сердцевина споры.
В настоящее время еще нет возможности классифицировать все пигменты, синтезируемые бактериями из рода Pseudomonas, согласно их принадлежности к веществам определенного химического состава.
К настоящему времени известно химическое строение только окрашенных веществ феназинового ряда, некоторых птеридиновых производных, пигментов пиррсльного и каротиноид-ного типов. Эти вещества были выделены в криеталлически чистом виде, а затем было проведено подробное изучение их химических и физических свойств.
Окрашенные соединения феназинового типа
К пигментам — производным феназина — относятся пиоцианин, гемипиоцианин, хлорора-фин, оксихлорорафин, феназин -1-карбоновая кислота, иодинин и эругинозин. Строение этих веществ известно, осуществлен их синтез. Все они являются антибиотиками, обладают активностью против грамположительных и грамот-рицательных бактерий, дрожжей и грибов, а также проявляют фитотоксические свойства.
Пиоцианин и гемипиоцианин — родственные химические соединения, образуемые культурой Ps. aeruginosa. Пиоцианин — синий нефлуоресцирующий пигмент -обычно образуется при культивировании Ps. aeruginosa на естественных и синтетических средах. Начиная с 90-х годов прошлого столетия ученые занимаются подбором сред, обеспечивающих максимальное образование антибиотика пиоцианина. Гемипиоцианин — пигмент желтого цвета.
Хлорорафин и оксихлорорафин — родственные химические соединения. Хророрафин зеленого цвета, оксихлорорафин — желтого. На воздухе хлорорафин быстро окисляется, превращаясь в оксихлорорафин. Эти вещества образуют бактерии Ps. aeruginosa и Ps. chlor or aphis.
Феназин-1-карбоновая кислота — пигмент желтого цвета, образуемый Ps. aeruofaciens. Этот пигмент могут синтезировать некоторые штаммы Ps. aeruginosa и Ps. fluorescens.
Иодинин — пигмент сине - фиолетового цвета с медным блеском — образуется при культивировании Ps. iodinum на синтетических и белковых средах.
Эругинозин — красный пигмент — синтезируется одной из культур Ps. aeruginosa. Этот пигмент состоит из двух веществ, которые были разделены на два пигмента А и В, полученные в кристаллически чистом виде. В 1 л культу-ральной жидкости содержится 12—20 мг пигмента А и 30—40 мг пигмента В. Оба вещества растворимы в воде и нерастворимы в щелочных растворах, на воздухе приобретают желтый цвет. При использовании новейших физико-химических методов анализа (магнитные резонансные спектры) была установлена структурная формула эругинозина В.
Окрашенные соединения феназинового типа могут синтезироваться бактериями рода Pseu-dornoiias в комплексе с другими веществами. Например, один штамм Ps. aeruginosa при определенных условиях может синтезировать одновременно три пигмента.
Окрашенные соединения птеридинового типа
Окрашенные формы псевдомонад синтезируют пигменты, в состав которых входят вещества птеридинового типа. Эти вещества были выделены в кристаллически чистом виде, а использование новейших химических и физических методов анализа позволило изучить их структуру. Птерины входят в состав пигментов и витаминов животной и растительной природы. Впервые они были обнаружены в цветных экстрактах крыльев бабочек и частях тела различных насекомых, в составе пигментов некоторых высших грибов и бактерий.
Среди окрашенных форм рода Pseudomonas часто встречаются виды, синтезирующие яркий желто-зеленый флуоресцирующий пигмент, хорошо диффундирующий в питательную среду. Кроме этих соединений, некоторые виды образуют вещества красного и синего цвета. В комплексе этих окрашенных соединений также обнаружены птерины.
Желто-зеленые флуоресцирующие пигменты. Интенсивность желто - зеленой флуоресцирующей пигментации псевдомонад зависит от условий культивирования, источников выделения и штамма. До настоящего времени точно еще неизвестно, какие органические соединения и сколько их входит в состав флуоресцирующего пигмента.
Начиная с 30-х годов нашего столетия исследователи пытаются установить химическую структуру этих веществ, изучая их в комплексе с другими соединениями, стремясь выделить их в кристаллически чистом виде.
Впервые Эллиот (1958) выделил в кристаллически чистом виде водорастворимый флуоресцирующий пигмент, синтезируемый Ps. fluorescens и Ps. ovalis. Применяя метод электрофореза, он изолировал это вещество и установил его птеридиновую природу. Чаркобарти с сотрудниками (1964), изучая химический состав пигментов, синтезируемых Ps. fluorescens, получил кристаллы светло-коричневого цвета.
Изучение химического состава этого вещества позволило авторам отнести его к птери-диновым производным.
Синие пигменты были обнаружены в клетках Ps. indigofera, которые окрашены в синий цвет. Эти соединения состоят из комплекса веществ различной окраски, где доминирует синяя. Синие пигменты птеридинового типа были получены в кристаллически чистом виде. Изучены их химические и физические свойства, проведен элементарный анализ компонентов и определена структурная формула. К синим пигментам относится индигоидин. Это внеклеточный пигмент фиолетово-синего цвета.
Синий внутриклеточный (нерастворимый) пигмент, также относящийся к птеридиновым производным, накапливается в большом количестве в бактериальных клетках Ps. lemonieri. Этот пигмент в субстрат не диффундирует.
Синий растворимый пигмент обнаружен при культивировании бактерий Ps. nigrifaciens. Коричнево-черные с темными кристаллами на поверхности, колонии этих бактерий содержат окрашенные и неокрашенные клетки, которые располагаются при росте в виде концентрических окружностей. Пигмент был выделен в чистом виде из клеток, затем хроматографи-чески разделен на три фракции: коричневого цвета, синего и флуоресцирующую желтого цвета.
Из очищенной фракции синего цвета были получены кристаллы. Изучены химические и физические свойства, проведен элементарный анализ и определена структурная формула соединения. По своим химическим и физическим свойствам этот пигмент сходен с инди-гоидином и относится к соединениям птериди-нового ряда.
Пигменты красного цвета. В 1937 г. Маршал изолировал из питьевого родника бактерию, синтезирующую смесь флуоресцирующих пигментов, в состав которых входит красный пигмент. Эта бактерия названа Pa. roseus fluorescens. Бактерии, развиваясь на синтетической среде без железа, синтезируют красный и зеленый флуоресцирующие пигменты. Эти соединения были выделены в кристаллически чистом виде и установлена их химическая природа. В состав комплекса этих пигментов входят птерины, рибофлавин и люмо-хром.
Окрашенные соединения типа пиррола.
Кроме птеридиновых пигментов, бактерии рода Pseudomonas синтезируют красные пигменты — антибиотики, принадлежащие к веществам типа пиррола: пиолутеорин, пирролнитрин, изопир-ролнитрин. Эти соединения были выделены из комплекса других окрашенных веществ в кристаллически чистом виде и установлена их химическая формула. Все эти вещества обладают антибиотической активностью против грамполо-жительных и грамотрицательных бактерий, дрожжей и грибов.
Окрашенные соединения каротиноидного типа.
В работах последнего времени описан ряд штаммов бактерий рода Pseudomonas, которые, развиваясь на специфических синтетических средах, синтезируют внутриклеточные нерастворимые в воде пигменты желтого, розового и красно-оранжевого цвета. Использование современных методов исследования (хроматография, электрофорез и т. д.) позволило установить каротиноидную природу этих соединений.
Так, Ps. echinoides и его мутантные формы, а также Ps. methanica при развитии на синтетической среде синтезируют комплекс желто-оранжевых пигментов каротиноидного типа.
Большое количество пигментов, синтезируемых псевдомонадами, обладает фоточувствительностью, флуоресценцией и различной степенью растворимости. Биологическая роль и пути синтеза этой обширной группы соединений почти не изучены. Тщательное исследование пигментов, образуемых псевдомонадами, необходимо не только для уточнения систематики этого рода, но и для изучения физиологии отдельных видов и штаммов псевдомонад.
Род галобактериум (HALOBACTERIUM)
К этому роду относятся облигатные галофи-лы, способные развиваться в питательных растворах, содержащих не менее 12% соли (NaCl). Экстремальные галофилы выделены норвежским ученым X. Ларсеном из насыщенных растворов солей. При понижении концентрации солей в окружающей среде клеточная стенка бактерий разрушается. Палочковидные клетки превращаются в шаровидные сферопласты. При дальнейшем понижении концентрации соли клетки взрываются, так как внутриклеточное осмотическое давление оказывается очень высоким. Как было изучено, энзимы этих экстремальных галофилов активны лишь при высокой концентрации солей К и Na. Такие микроорганизмы, являясь гетеротрофами и используя энергию органических соединений, погибают в присутствии избытка пищи при поступлении воды в среду, понижающей концентрацию солей. Они не могут не быть галофилами. Являясь представителями своеобразной группы «высоленных форм» жизни, эти микробы обречены на существование в условиях соляной рапы. Любопытно отметить, что поиски этих форм были начаты с порчи рыбы и цветения соли в соляных испарительных бассейнах США (цветение соли отражает массовое развитие экстремальных галофильных бактерий, образующих розовый пигмент).
Род бделловибрио (BDELLOVIBRIO)
Исключительный интерес представляют недавно описанные немецким исследователем Г. Штольпом (1963) бактерии, паразитирующие внутри клеток других грамотрицательных бактерий. В пределах рода достоверно описан один вид — Bdellovibrio bacteriovorus. Бактерия представляет собой мелкую грамотрица-тельную, слегка изогнутую палочку. Размеры клетки: длина — 1 мкм, толщина — 0,3 мкм. Клетки снабжены одним полярно расположенным толстым жгутом (толщина 28 нм по сравнению с типичным жгутиком бактерий, толщиной 15—20 нм). Прикрепляясь к клетке-хозяину, паразит проникает внутрь клетки и развивается там. Именно все эти свойства побудили первооткрывателей дать этим бактериям приведенное выше название. Латинское слово «Bdello», означающее «пиявка», в сочетании с «vibrio» (вибрион) составило родовое название. «Vorus» — значит «пожирающий» — в сочетании с «bacterio» составило видовое название. В итоге эти, несомненно, интересные бактерии получили интригующее название «пиявко-вибрион, пожирающий бактерии».
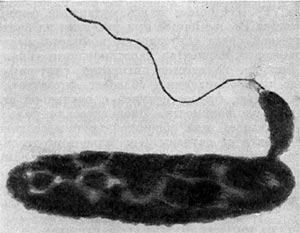
Рис. 22. Прикрепление паразитической бактерии Bdellovibrio к клетке хозяина — Pseudomonas (по Штольлу, 1963).
Немало хлопот доставляет этот организм исследователям ввиду его очень мелких размеров: он проходит через мелкопористые фильтры с диаметром пор, равным 0,45 мкм и даже 0,22 мкм, на которых задерживаются другие бактерии. Bdellovibrio bacteriovorus отличается от подобных ему бактерий прежде всего по тонкому строению жгутика. Он состоит из двух частей — сердцевины (толщина 13 нм) и чехла (7,5 нм), который покрывает жгутик. Чехол является продолжением клеточной стенки на жгутике. На противоположном полюсе клетка-паразит оснащена слизистой маской, лежащей сверху на складках, образованных клеточной стенкой. Этой частью паразит прикрепляется к поверхности клетки-хозяина (рис. 22). Здесь же можно часто видеть очень тонкую (45—55 А) короткую (0,8 мкм) нить, которая, как предполагают, подтягивает клетку-паразита к атакуемой клетке-хозяину. По тонкому строению клетки-паразита неотличимы от обычных грамотрицательных бактерий. Лишь мелкие размеры и способ добывания пищи выделяют их — они проникают внутрь клеток-хозяев и там развиваются (рис. 23 и 24).
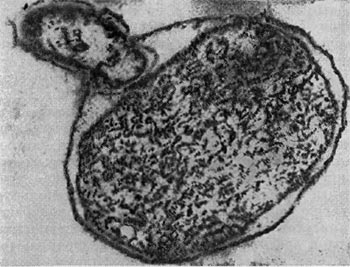
Рис. 23. Прохождение паразита внутрь клетки-хозяина. Ультратонкий срез (по Штольпу, 1963).
Клетки-паразиты не случайно сталкиваются с клетками-хозяевами, а активно ищут их. К слову, следует заметить, что паразиты перемещаются быстрее, чем многие другие клетки бактерий. Если поиск увенчался успехом, то можно под микроскопом увидеть удивительную картину преследования клетки-хозяина (какая - либо грамотрицательная бактерия) двумя-тремя клетками-паразитами. Преследуемая клетка активно сопротивляется, сбрасывая с помощью резких движений прикрепившихся паразитов. Иногда одну клетку-хозяина преследуют несколько клеток - паразитов. Такое разыскивание, преследование и, наконец,внедрение в клетку-хозяина протекает бурно и напоминает атаку (так и называется этот процесс в литературе). Прикрепление паразита начинается с вращательного движения вокруг своей оси, но может быть и шарнирным движением конца клетки-паразита на клеточной стенке хозяина. Скорость вращения достигает 100 об/мин. Прикрепившиеся клетки-паразиты очень прочно связаны с клеткой-хозяином. Их невозможно отделить ни встряхиванием, ни ультразвуком. При длительной обработке они гибнут вместе с хозяином, но не отделяются.
При вращении клетка-паразит пробуравливает клеточную стенку хозяина (см. рис. 23); паразит, проникнув внутрь клетки-хозяина, оттесняет протопласт и располагается между клеточной стенкой и цитоплазматической мембраной, где он многократно размножается. Клетка-хозяин похожа на «мешок», набитый паразитами (20—50 клеток-паразитов в одной клетке-хозяине; рис. 25). Эти интересные наблюдения проведены советскими исследователями Е. Н. Мишустиным и Э. С. Никитиной.
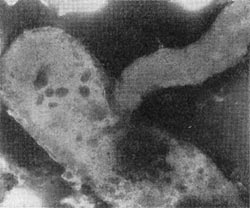
Рис. 24. Атака паразитической бактерией клетки-хозяина. Увел, х 35000.
В настоящее время известно довольно много бактерий, различающихся морфологически, которых относят к роду Bdellovibrio, причем наряду с мелкими вибрионоподобными клетками встречены довольно крупные палочки. Это не должно удивлять, так как в процессе проникновения в клетку через сравнительно маленькое отверстие клетка-паразит сужается и как бы продавливается через отверстие, «просачиваясь» внутрь клетки-хозяина.
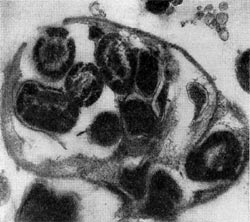
Рис. 25. Клетка бактерии-хозяина (Tuberoidobacter sp.), заполненная размножившимися паразитами. Электронная микрофотография. Увел, х 40000.
Процессы атаки, внедрения паразита внутрь клеток-хозяев протекают очень быстро. Спустя 2—3 мин после атаки клетки-паразиты внедряются в клетки-хозяев. По истечении 10— 60 мин они полностью проникают в хозяев, а через 3—5 ч, завершив разрушение атакованных ими клеток-хозяев, паразиты освобождаются из разрушенных клеток. Инфицированная паразитом клетка уже вскоре после атаки подвергается большим структурным изменениям, что связано в первую очередь с нарушением целостности и прочности клеточной стенки. Изменяются контуры клетки — возникают шаровидные сферопласты. Вслед за стенкой идет разрушение содержимого клеток.
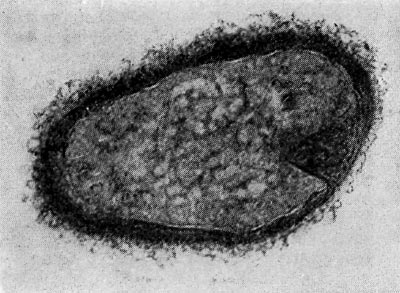
Рис. 26. Цисты (форма покоя) паразитических бактерий Bdellovibrio. Увел. X 50000.
Наряду с паразитическими формами Bdellovibrio возникают сапрофитные, образующие желтый пигмент. Е. Н. Мишустину и Э. С. Никитиной удалось доказать, что часть паразитов, выбравшись из обломков разрушенной ими клетки-хозяина, переходит не к сапрофитному способу питания, а в состояние покоя, образуя цисты. Это овальные, почти круглые клетки с уплотненной ядерной зоной и толстой оболочкой. Размеры их необычайно малы, и они оставались не замеченными многими микробиологами (рис. 26).
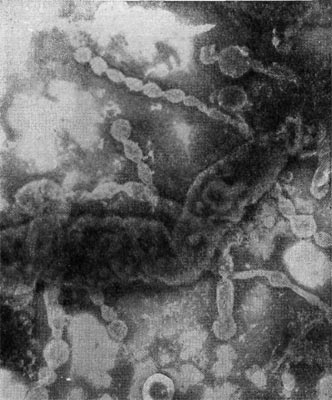
Рис. 27. Разрушенная клетка неспороносной палочки. Видны выброшенные из клетки цепочки внутриклеточных мембран (мезосом). Увел. X 25000.
Особый интерес представляет конечный результат атаки и развития паразитов в клетках других бактерий — их разрушенные (лизиро-ванные) остатки. Такие остатки (детрит) часто обнаруживаются в субстратах, где живут микробы. Они остаются после отмирания стареющих клеток микробных популяций, особей, лизированных фагами, и др. Все указанное относится к эндогенному типу лизиса, когда действующий фактор (в случае отмирания старых клеток сказывается разрушение клетки изнутри ферментами) находится внутри клетки и его действие направлено от центра к поверхности клетки. Bdellovibrio атакует клетку сверху, нарушая целостность клеточной стенки и лишь затем проникая внутрь. Клеточная стенка хозяина разрушается под влиянием ферментов паразита, обнажая ленты мембранных структур (рис. 27). Атакованные паразитами клетки с нарушенной стенкой часто образуют вздутые за счет внутреннего осмотического давления клетки (сферопласты), из которых вышвыриваются наружу цепочки мембран -внутренние структуры (интрацеллюлярные мембраны), на которых ориентированы ферменты, обеспечивающие важнейшие жизненные функции клетки. Эти остатки клеток-хозяев, убитых бактериями-паразитами, еще долгое время остаются в среде, лишь постепенно разрушаясь под влиянием уже других, обычных сапрофитов — «мусорщиков», но все еще остаются на поле битвы следы веществ — индикаторов бурных процессов гибели клеток — составные части клеточных стенок бактерий: мурамовые кислоты, составляющие мешок, покрывающий клетки.
Паразитические бактерии Bdellovibrio широко распространены в природе. Они встречаются в воде рек, озер, морей, в почвах разных географических зон в сравнительно небольших количествах, как бы выжидая момента атаки в случае появления большого количества клеток других бактерий, в первую очередь больных. В этом случае активизируются не только клетки паразита, но и его формы покоя — цисты, которые быстро прорастают. Bdellovibrio выполняют роль волков в микробном сообществе, выедая не всю, а часть популяций клеток (никогда не наблюдалось полного уничтожения хозяев). Объектами атаки (хозяевами) паразитов являются практически все бактерии, но в первую очередь грамотрицатель-ные, в том числе возбудители опасных эпидемических болезней, например холеры. Использование Bdellovibrio (предварительно накопленного в лабораторных условиях) для обеззараживания воды в водоемах уже нашло применение. Характер взаимоотношений Bdellovibrio-пaразита с другими бактериями-хозяевами является ярким примером широко распространенного в живом мире нашей планеты одного из трех способов добывания пищи. Два других — сапрофитный и хищный способ добывания пищи. Тем не менее между этими способами нет больших различий. Сапрофиты питаются мертвыми микроорганизмами, хищники убивают сами или пользуются услугами других «убийц», а паразиты поедают своих хозяев постепенно, совсем не стремясь их убить, по крайней мере немедленно. Таким образом, все живые существа могут быть разделены на «пожираемых» и «пожирающих», и исследование явления паразитизма на любом уровне представляет общебиологический интерес.
Другие псевдомонады
Род ацетомонас (Acetomonas)
К этому роду принадлежат грамотрицательные палочковидные бактерии-монотрихи, способные окислять этанол только до уксусной кислоты. К ним близки представители рода ацетобактер (Асеtobacter) и другие, окисляющие уксусную кислоту до конца.
Род зимомонас (Zymomonas)
Сюда включены палочковидные бактерии с полярным жгутиком, достигающие 2 мкм длины. Сбраживают глюкозу до спирта (около 10%), молочной кислоты и С02. Факультативные анаэробы. Встречаются в бродящих растительных соках.
Семейство бактерии (BACTERIACEAE)
К этому семейству принадлежат грамотрицательные бактерии с перитрихиальным жгути-кованием. Большинство представителей этого семейства — сапрофиты, свободно живущие в воде (пресной и морской), почве, сточных водах, на разлагающихся остатках животных и растений. Сходство между ними очень велико, что часто затрудняет отнесение их к отдельным родам. Часть представителей семейства имеет важное значение для промышленности, сельского хозяйства и медицины. К семейству относится более сотни видов.
Многие виды хорошо сохраняются в воде, почве, сточных водах, молочных продуктах и на растениях. Некоторые патогенны для растений (эрвиниа — Erwinia); другие являются возбудителями тяжелых заболеваний человека: брюшного тифа (сальмонеллы — Salmonella typhi), паратифов, дизентерии (шигеллы — Shigella). Меньшей патогенностью обладают бактерии из рода протеус (Proteus), хотя и они являются возбудителями тяжелых инфекций. Сюда же относится широко распространенная в природе хромобактерия Chromobacterium prodigiosum — палочка чудесной крови, обладающая способностью образовывать кроваво-красный пигмент при развитии на пищевых продуктах. В средние века те люди, у которых хлеб покрывался колониями красного цвета Chromobacterium prodigiosum, подвергались гонениям, вплоть до сожжения на костре в качестве «сообщников дьявола». Так безобидная сапрофитная палочка оказывалась из-за невежества церковников источником страшных бед для многих людей.
В семейство Bacteriaceae входят также представители клубеньковых бактерий (Bacterium radicicola) и рода агробактериум (Agrobacte-rium). Клубеньковые бактерии — Bacterium radicicola, синоним — ризобиум (Rhizobium) будут рассмотрены в разделе, посвященном основной физиологической функции этих бактерий — способности фиксировать атмосферный азот в симбиозе с высшими растениями.
Род бактетриум (BACTERIUM)
Представлен организмами с грамотрицательными мелкими палочковидными клетками с перитрихиальным жгутикованием.
Одной из наиболее изученных бактерий рода Bacterium является кишечная палочка Bacterium coli (в ряде определителей описывается под другим названием — Escherichia coli). Эта палочка всегда содержится в кишечнике людей и животных. Поэтому обнаружение ее в воде и пищевых продуктах свидетельствует об их загрязнении. Некоторые штаммы (разновидности) Bacterium coli вызывают заболевания у людей.
Вряд ли можно назвать другой микроорганизм из огромного мира микробов, который был бы в такой степени изучен и использовался бы в качестве модели для бесчисленного множества исследований энзиматических процессов, закономерностей роста и развития бактерий, тонкого строения клеток, изучения гене тических закономерностей и многого другого, как кишечная палочка. Эта бактерия сыграла в микробиологии, биохимии и генетике такую же роль, как лягушки, кролики и собаки в физиологии и медицине. Именно на Bacterium coli была установлена особенность строения клеточной стенки грамотрицательных бактерий, подтверждена способность неспороносных бактерий выживать длительное время в замороженном состоянии в условиях Антарктиды. Показано, что замораживание при температуре —70 "С и даже при сверхнизкой температуре —195 °С меньше повреждает бактерии, чем замораживание при —20 °С, особенно в случае чередующегося замораживания — оттаивания, что приводит к гибели большинство клеток. В последующем эти сведения были широко использованы в науке и производстве. Исследовалось также отношение бактерий к температуре и установлен порог (45—50 °С), за пределами которого мезофилы (средние по выживаемости при повышенной температуре) не развиваются.
Кишечная палочка оказалась пригодной моделью для выяснения отношения бактерий к засоленности среды. Нижний порог концентрации соли (NaCl) оказался равным 3,5 %.
Исследования, проведенные на кишечной палочке, дали возможность детально изучить биосинтез макромолекул (нуклеиновых кислот, белков) в микробной клетке. Было установлено, что в период активного роста и размножения все процессы биосинтеза макромолекул строго сбалансированы. При влиянии отдельных факторов среды (продуктов обмена веществ, например, аминокислот) действие некоторых ферментов тормозится, что нарушает нормальный метаболизм у микробных клеток. Это приводит к болезни клеток, к возникновению патологически измененных (инволюционных) форм и гибели популяции (сообщества) бактерий.
Прокариотные организмы, типичным представителем которых является Bacterium coli, не обладают истинным ядром, а лишь ядерной зоной, где находятся фибриллы ядерной нуклеиновой кислоты (ДНК) — генетический материал клетки. При быстром лизисе клеток спиральная молекула ДНК выпадает в виде длинной нити, превышающей по длине во много раз клетку бактерий. Например, при длине клетки Bacterium coli 2 мкм длина ДНК — 1100—1400 мкм. Внутри клетки ДНК свернута и не имеет свободных концов, т. е. кольцеобразна. У бактерий имеется одна хромосома, каждый участок которой — ген — ответствен за отдельное наследственно закрепленное свойство бактерий. Для кишечной палочки составлена генетическая карта, на которой указаны места локализации и последовательность генов на кольцевидной хромосоме. Этому предшествовала огромная аналитическая работа, позволившая установить общебиологические закономерности на бактериальном тест -объекте. Для бактерий свойствен половой процесс, сопровождающийся передачей генетического материала при контакте клетки с клеткой — так называемая конъюгация. При этом клетки соединены мостиком, через канал которого генетический материал передается от клетки-донора к клетке-реципиенту. Такая пара клеток объединяется с помощью особых коротких фимбрий, обладающих каналом внутри. По этим каналам передается прежде всего фактор F -- фрагмент ДНК, по величине соответствующий фаговой ДНК, и затем часть хромосомы. Детали механизма передачи хромосом в настоящее время изучаются на Bacterium coli. Трудно переоценить вклад кишечной палочки в современную микробиологию, биохимию и генетику.
Многими исследователями описан ряд видов рода Bacterium, образующих либо не образующих пигменты, широко распространенных в природных средах обитания — в почве, иле, воде. Они играют исключительно важную роль в круговороте веществ в биосфере.
Другие роды семейства
Род хромобактериум (Chromobacterium)
К этому роду принадлежат бактерии, образующие фиолетовый водонерастворимый пигмент — продукт окисления аминокислоты триптофана. Эти бактерии сходны по физиологии с аэробными псевдомонадами.
Род флавобактериум (Flavobacterium)
Представители рода широко распространены в почве и воде, некоторые из них подвижны. Пигмент чаще не образуется. Способны использовать широкий спектр органических веществ. Отдельные виды и штаммы разлагают лигнин (важное вещество природного растительного опада) и некоторые гербициды (вещества, подавляющие развитие растений-сорняков на полях). Сами гербициды и продукты их превращения опасны для человека и животных. К флавобактериям близки бактерии из рода Агарбактериум (Agarbacterium), способные разлагать агар (полисахарид водорослевого происхождения, используемый в лабораторных средах).
Род фузобактериум (Fusobacterium)
В этот род входят облигатно анаэробные грамотрица-тельные палочки, встречающиеся в пищеварительном тракте животных.
Род ахромобактер (Achromobacter)
Представители рода широко распространены в природе, являясь типичными аэробными гетеро-трофами. Хотя они морфологически сходны с бактериями кишечной группы (Bact. coli), серологически между ними родственные связи не проявляются. Многие виды являются обитателями ризосферы (зоны корня) растений. Способны к разложению гербицидов, что характеризует их роль в самоочищении почвы от загрязнения ее неприродными веществами.
Род агробактериум (Agrobacterium)
Типичные представители рода чаще подвижные, аэробные, грамотрицательные палочки. Многие виды патогенны по отношению к растениям. Клетки мелкие (0,2—0,8x1,0—3,0 мкм). Некоторые клетки имеют один жгутик в полярном или латеральном положении; для других характерен пучок или перитрихиальное расположение жгутиков. Количество и локализация жгутиков зависят от питательной среды. Это лишний раз подчеркивает ненадежность характера жгутикования клеток как таксономического признака, и читателю легко оценить несовершенство существующего разделения на отдельные таксономические группы неспорообразую-щих подвижных бактерий по одному из признаков.
Многие виды рода Agrobacterium участвуют в превращении лигнина и гумусовых веществ в почвах. Ряд видов способен, подобно клубеньковым бактериям, жить в тканях растений или в тесной ассоциации с ними.
К этому роду отнесен недавно описанный автором настоящей главы новый почвенный микроорганизм — Agrobacterium polyspheroidum. Клетки этой бактерии представляют собой палочки, вся поверхность которых усеяна сферическими выростами, расположенными по спирали. Размеры клеток средние (0,6—0,8 х l,2—5,1 мкм), но диаметр сферических вздутий очень мал (0,015—0,07 мкм). Поэтому их можно различить только в электронном микроскопе (рис. 28). Молодые шаровидные клетки снабжены одним жгутиком. Размножаются перетяжкой с образованием дочерней подвижной клетки, часто с несколькими жгутиками. Кроме того, клетки нередко образуют почки, длительное время дорастающие до размеров материнской клетки, не отделяясь от нее. По уровню питательных веществ в среде этот организм следует отнести к олиготрофотоле-рантным бактериям, т. е. к бактериям, способным использовать следовые количества источников пищи. Часто встречаются в разных типах почв Европы, Азии и Америки.
Род тубероидобактер (Tuberoidobacter)
В этот род были выделены автором настоящей главы в 1970 г. неизвестные ранее грамотрицатепьные, гетеротрофные, аэробные палочки с бугристыми выростами, чем и определился родовой эпитет (tuberoid — бугорок). Клетки крупные (2—5 х 0,8—0,9 мкм), усеянные бугорчатыми выростами (на ультратонких срезах видно, что выросты сформированы клеточной стенкой и цитоплазматической мембраной, что роднит их с почкующимися и стебельковыми бактериями). Выросты различимы не только в электронном микроскопе, но и в световом (рис. 29). Клетки делятся перетяжкой с образованием меньшей дочерней клетки, снабженной одним или несколькими жгутиками. Бактерии способны также образовывать почки, длительно не отделяющиеся от материнской клетки и достигающие размеров, превышающих материнские. Часто на дочерней клетке, не отделенной от материнской, образуются также почки, в результате чего возникает сложный конгломерат, состоящий из 3—5 и более клеток. Иногда на одной материнской клетке образуется несколько почек. Типовой вид рода — Tuberoidobacter mutans.
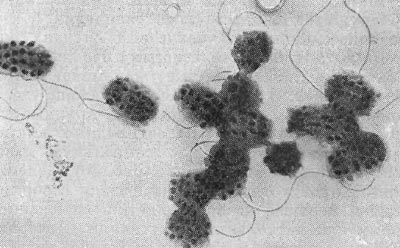
Рис. 28. Почвенная бактерпя со сферическими выступами на поверхности клетки (Agrobacterium polyspheroidum). Увел. X 15000.
По потребностям в источниках энергии эти бактерии относятся к олиготрофам. Повышенные концентрации углеводов тормозят рост, а аминокислоты вызывают заболевания клеток и патологические изменения, завершающиеся гибелью особей. Организмы встречены в почвах с высоким содержанием гумуса и растительного спада. Бактерии из рода Tuberoidobacter обладают признаками, роднящими их как с родом Agrobacterium, так и с почкующимися бактериями.
Род селибериа (Seliberia)
Бактерии, образующие звездообразные скопления, были впервые обнаружены Т. В. Аристовской (1965) - и выделены в самостоятельный род, которому присвоено название Seliberia (по фамилии советского микробиолога Селибе-ра). Эти бактерии очень широко распространены в подзолистых почвах и могут быть выявлены с помощью капиллярного метода Б. В. Перфильева и Д. Р. Габе, в частности, при применении почвенных педоскопов. Педоскопы представляют собой небольшие тонкие пластинки, внутри которых имеются капиллярные каналы. При помещении в толщу почвы в каналах развиваются природные сообщества микроорганизмов, так как каналы педоскопа служат как бы продолжением капиллярных (волосных) ходов самой почвы. За разработку капиллярных методов исследования микрофлоры илов и почв Б. В. Перфильев и Д. Р. Габе удостоены Ленинской премии. Применение капиллярных методов позволило ученым сделать ряд важных открытий. При микроскопировании стенок капилляров педоскопа, пробывшего в подзолистой почве.
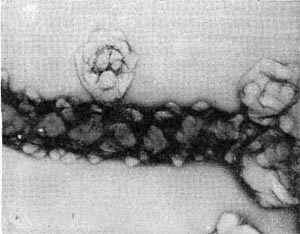
Рис. 29. Клетка бактерии с бугристыми выростами представитель нового рода Tuberoidobacter. Увел. X 30000.
В течение нескольких недель, как правило, обнаруживаются звездчатые скопления бактериальных клеток. В некоторых случаях они покрыты мощными железистыми отложениями. Такие скопления (розетки) напоминают крошечных ежей. В электронном микроскопе удается рассмотреть, что эти довольно крупные (до 10—15 мкм длиной) палочковидные клетки имеют четко выраженную спиральную извитость, напоминающую канат (рис. 30). Деление клеток происходит путем перетяжки с образованием меньшей дочерней клетки, снабженной одним или несколькими жгутиками. Дочерние клетки активно подвижны и слабо извиты. В последующем клетки объединяются в группы, образуя розетки, соединенные слизистой массой, выделяемой одним из полюсов клетки. Встречаются также ветвящиеся клетки.

Рис. 30. Группа клеток Seliberia, образующих звездообразную розетку (по Аристовской 1965). Увел. X 15000.
По физиологическим свойствам бактерии рода Seliberia являются типичными гетеротро-фами и способны развиваться в средах для сапрофитных бактерий, лучше в жидких, чем в плотных средах. Хорошо растут на агаризо-ванной воде и почвенном экстракте. При росте на обычных лабораторных средах морфология клеток значительно изменяется. Иногда клетки сильно вытягиваются и образуют уродливые формы, что свидетельствует о несоответствии обычно принятых сред природным субстратам. Являясь типичными олиготрофами (организмами, растущими на средах с очень низкой концентрацией органических веществ), Seliberia почти не накапливают продуктов обмена в процессе своего развития на органических средах. На средах с углеводами не образуется ни кислоты, ни газа.
В отдельных случаях отмечается очень слабое повышение рН среды. Единственный продукт обмена, который обнаруживается в заметных количествах при выращивании бактерий на гумусовых (гумус — органическое вещество почвы) средах,— гидрат окиси железа. Так как Seliberia не является автотрофом, образование гидроокиси можно объяснить лишь тем, что железо, прочно связанное хелатной (комплексной) связью с гумусом, высвобождается под влиянием бактерий-спутников (они всегда встречаются вместе с Seliberia). Бактерии-спутники активно разлагают гумусовый компонент, а железо в виде гидрата окиси железа оседает на колониях Seliberia со спутниками.
В природе звездообразующие бактерии рода Seliberia встречаются в разных состояниях. Иногда они покрыты отложениями, в других случаях эти отложения отсутствуют. Хотя в биологической аккумуляции железа Seliberia уступает другим видам бактерий, все же их роль в накоплении железа в почве значительна. Можно видеть в толще почвы зоны (пласты) оруднения (металлические слои), которые легко извлечь в виде небольших пластин. В этих процессах роль Seliberia несомненна.
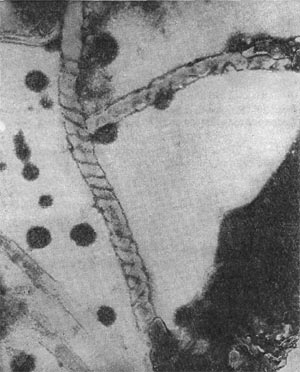
Рис. 31. Извитые клетки неизвестной бактерии. Увел.Х 20000.
Наряду с изученным Т. В. Аристовской типовым видом Seliberia stellata в некоторых южных почвах встречаются подобные организмы, представляющие собой очень длинные клетки, мелко извитые (рис. 31).
На примере изложенного материала читатель легко может заключить, что проблемы систематики бактерий являются одними из наиболее сложных. Так, например, представители рода Seliberia морфологически подобны как типичным неспорообразующим перитри-хам, так и проактиномицетам (ветвление). Являясь гетеротрофами, они обладают уникальными особенностями физиологии (экономный обмен веществ). Несомненно, они занимают особое положение среди неспорообразующих бактерий.
Семейство спириллы (SPIRILLАСЕАЕ)
Представители семейства Spirillaceae имеют форму изогнутых или спиральных клеток, характеризующихся жесткой несгибаемой структурой. Почти все представители семейства близки по многим свойствам к псевдомонадам. Виды этого семейства весьма многочисленны. Среди родов, принадлежащих к этому семейству, наибольшую роль в природе и производстве имеют Vibrio, Cellvibrio, Selenomonas, Microcyclus и др.
Род вибрио (Vibrio)
Свое название эти микробы получили за их способность к быстрым колебательным движениям (от лат. «vibrare» — колебаться). Вибрионы имеют форму коротких, изогнутых в виде запятой палочек. После деления они часто остаются сцепленными концами, образуя спирали. Это — неспорообразующие грамотрицательные бактерии с полярно расположенным жгутиком, типичные гетеротрофы. Они не способны расщеплять клетчатку. Многие используют фенолы и другие циклические соединения. Длина отдельных вибрионов редко превышает 10 мкм, а их диаметр от 1 до 1,5 мкм. Некоторые из них — строгие анаэробы, другие — облигатные аэробы или факультативные анаэробы (растущие в присутствии кислорода и при пониженной концентрации его). В основном это сапрофиты, широко распространенные в загрязненных реках и озерах нашей планеты.
Все же среди представителей этого рода существует несколько видов, патогенных для человека и животных. Сюда относится прежде всего возбудитель холеры (Vibrio comma), выделенный в 1886 г. Р. Кохом из испражнений больных животных. Он может долгое время сохраняться в воде загрязненных рек и озер. Другие виды, вызывающие заболевания людей, — Vibrio proteus и Vibrio El Tor — также опасны. Дорогой ценой оплатило человечество за коварный характер этих вибрионов. Во многих странах Европы можно увидеть много обелисков, посвященных избавлению от холерных эпидемий — естественному затуханию эпидемий, свирепствовавших в течение нескольких лет подряд. Миллионы человеческих жизней были унесены этой мелкой неспорообразующей бактерией. Неописуем ужас людей средневековья перед надвигавшейся на них неизбежной смертью. В настоящее время холера практически побеждена, а в случае заболеваний успешно лечится, в чем большую роль играют антибиотики.
Род селеномонас (Selenomonas)
Представители этого рода являются очень строгими анаэробами. Они обитают в рубце (отделе желудка) жвачных животных (коров, оленей и др.). Морфологически селеномонады представляют собой мелкие вибрионы (длина клетки 2 мкм), снабженные пучком жгутиков, расположенных латерально на вогнутой части клетки. Это типичные неспорообразующие грамотрицательные гетеротрофные бактерии, участвующие в переработке пищи в желудке животного. Их выделение в чистую культуру связано с большими трудностями, так как селеномонады погибают на воздухе в течение нескольких секунд. Культивирование селеномо-над проводится в атмосфере углекислоты, очищенной от следов кислорода.
Род целлвибрио (Cellvibrio)
Бактерии, принадлежащие к этому и другим близким родам, чрезвычайно широко распространены в природе. Это грамотрицательные неспорообразующие вибрионы с длиной клетки до 2 мкм. Типичные гетеротрофы, расщепляющие целлюлозу в растительных остатках, систематически поступающую в почву с растительным спадом. Многие из них способны разлагать парафин и циклические соединения. В лабораторных условиях успешно культивируются на фильтровальной бумаге, наложенной на питательную среду в аэробных условиях. Роль этой группы микроорганизмов исключительно велика, так как они обеспечивают распад важнейшего природного вещества — целлюлозы — и перевод его в соединения, доступные для других организмов, не обладающих ферментным аппаратом, позволяющим расцеплять целлюлозу. Более того, целлюлоза является главным энергетическим материалом, поступающим в природные субстраты за счет основного процесса на нашей планете — фотосинтеза. Затем следует цепочка превращений органических веществ, заканчивающаяся их полной минерализацией. Это обеспечивает нормальный круговорот веществ в природе.
Род микроциклюс (Microcyclus)
К этому роду принадлежат грамотрицательные неспорообразующие бактерии, форма клеток которых напоминает кольца (рис. 32). Обычно размеры клеток невелики (1 мкм), но во время роста клетки образуют замкнутые кольца, диаметр которых 2—3 мкм. Один из недавно описанных представителей этого рода — Microcyclus major (Б. В. Громов, 1963) — характеризуется более толстыми клетками (1—2 мкм) и большим диаметром колец (5 —10 мкм). Организмы из рода Microcyclus и родственного рода Spirosoma неподвижны, жгутики отсутствуют, но у Microcyclus major при развитии на почвенных средах (агаризованная почва) образуется пучок фим-брий (см. выше), с помощью которых клетки объединяются в звездообразные скопления (розетки), подобно бактериям из рода Seliberia.
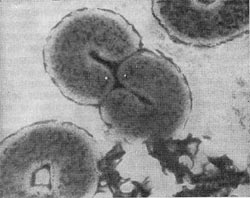
Рис. 32. Тороидальные клетки Microcyclus flavus. Электронная микрофотография. Увел. X 25000.
Являясь гетеротрофами, бактерии из рода Microcyclus и в первую очередь Microcyclus major сильно меняют морфологию своих клеток на богатых средах, где главным действующим фактором являются многие аминокислоты в низкой концентрации (0,02% и меньше). При этом возникают патологические формы клеток: гигантские нити, многократно ветвящиеся клетки, большие шары (сферопласты и протопласты, лишенные клеточной стенки), нитевидные фрагменты со вздутиями, неотличимые от микоплазм (см. стр. 321). По истечении небольшого времени инволюционные формы отмирают. Это значит, что бактерии из рода Microcyclus лвляются довольно типичными олиготрофами, страдающими от избытка пищи. В основе влияния аминокислот на микробы лежит нарушение синтеза клеточной стенки, что ведет к возникновению такого обилия уродливых форм и последующей гибели клеток.
Род спиросома (Spirosoma)
Впервые этот род был описан еще в 1894 г., где были объединены описанные ранее (1875 и 1887 гг.) вибрио-подобные организмы. В дальнейшем культуры были потеряны, а род практически забыт, но в 1968 г. вновь обнаружены формы бактерий, напоминающие спиросомы.
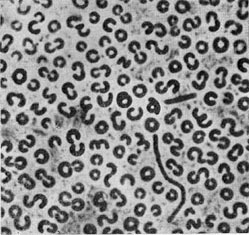
Рис. 33. Тороидальные клетки Spirosoma sp. Фазовоконтрастный микроскоп. Увел. XI600.
Бактерии, относящиеся к этому роду, близки по морфологии к представителям рода Microcyclus. Клетки этих бактерий образуют замкнутые кольца (рис. 33). Разделившиеся клетки, оставаясь вместе, накладываются друг на друга и формируют длинные спирали, число витков в которых от 20—30 до 100. Отдельные клетки невелики (толщина — 0,6—1 мкм, длина — 3,5 мкм), но длина спирали достигает 40— 50 мкм. Этот организм также характеризуется полиморфизмом.
Наряду с нормальными клетками на богатых средах встречаются очень длинные нити (более 50 мкм), сферопласты (клетки, частично потерявшие клеточную стенку).
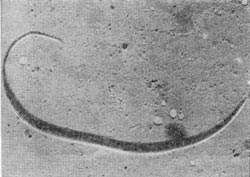
Рис. 34. Червеобразная клетка со сверхтонкими концами неизвестной неспороносной бактерии, обитающей в иле пресного озера в Подмосковье. Увел, х25000.
Все представители рода Spirosoma являются типичными сапрофитами, обитателями воды и ила пресных водоемов, реже встречаются в почвах.
Род ренобактер (Renobacter)
Этот род был введен недавно (Д. И. Никитин, 1970). Описан типовой вид Renobacter vacuolatum (от лат. «ген» — почка). Бобовидная клетка этой бактерии напоминает человеческую почку (табл. 31). Размеры клеток невелики (длина — 1,6 — 1,8 мкм, диаметр — 0,7 —1,0 мкм). Организмы не имеют жгутиков, капсул и спор и являются типичными грамотрицательными бактериями. Характерная особенность этой бактерии — наличие внутри клетки 40—60 газовых вакуолей цилиндрической формы. Отдельные газовые вакуоли окружены тонкими однослойными мембранами и могут заполняться газом (по-видимому, азотом) либо смыкаться. В зависимости от числа раскрытых вакуолей клетки в водной суспензии могут оседать на дно сосуда либо находиться стабильно во взвешенном состоянии и даже плавать в виде пленки на поверхности жидкости. Это дает основание предположить, что у бактерий, лишенных способности к активному движению, выработался принципиально иной механизм перемещения в жидких средах (в том числе в капиллярах, заполненных почвенным раствором). Регулируя число заполненных газом вакуолей, эти организмы при небольших затратах энергии могут перемещаться в зону оптимальных концентраций питательных веществ или уходить от неблагоприятных воздействий среды. Поэтому вполне естественным оказывается распространение Renobacter в почвах с сильным увлажнением, в поймах рек, иле и воде пресных водоемов.
Являясь гетеротрофом, Renobacter vacuolatum на богатых лабораторных средах при избытке белков и аминокислот образует патологически измененные (больные) клетки. Это свидетельствует о том, что Renobacter относится к экологической группе олиготрофов, т. е. организмов, способных развиваться при низких концентрациях пищи. Ее избыток ведет к патологии и гибели клеток.
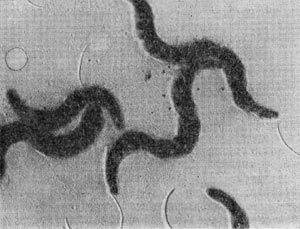
Рис. 35. Клетки крупных спирилл — обитателей пресных водоемов. Увел. X 20000.
Помимо организмов, которых можно более или менее четко отнести к какой-либо таксономической группе, в природных субстратах встречаются новые, неизвестные еще организмы. Такими являются тонкие червеобразные клетки с загнутыми, как правило, очень тонкими концами (рис. 34). Если диаметр клетки этой бактерии равен 0,3—0,5 мкм, то толщина ее концов не превышает 0,07 мкм, и они не могут быть рассмотрены в световом микроскопе. Мир микробов нашей планеты продолжает удивлять и озадачивать нас.
Род спириллум (Spirillum)
Если не считать одной самой мелкой спириллы, то к этому роду относятся лишь безвредные для человека сапрофиты — «мусорщики», соседствующие вместе с вибрионами в тихой заводи стоячих и загрязненных вод (рис. 35) и в гниющих остатках растительного и животного происхождения.
Большинство спирилл относительно крупные (5—40 мкм в длину и 0,5—3,0 мкм в диаметре). Они изогнуты и образуют спираль из нескольких оборотов. Подвижность спирилл обеспечивается одним или пучком жгутиков, прикрепленных к одному или к обоим полюсам клетки. Наиболее мелкий представитель рода — Spirillum minus — патогенен, наиболее крупный — Spirillum volutans — типичный сапрофит.
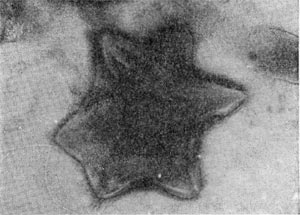
Рис. 36. Шестиугольная клетка новой грамотрицательной бактерии, встречающейся в ипах и торфах. Увел.х 30000.
Новые организмы
Как неоднократно отмечалось, состязание систематики микроорганизмов со все новыми загадками природы продолжается непрерывно. Предъявленный недавно для опознания объект — грамотрицательная не-спорообразующая бактерия с клеткой шестиугольной формы (рис. 36) — не может быть отнесен ни к одному из существующих таксонов (группы классификации) и отнесен сам к себе, оставаясь единственным представителем данной группы. Эта группа получила случайное название — Stella (звезда).
Семейство бациллы (BACILLACEAE)
Палочковидные анаэробные и аэробные бактерии, способные образовывать термоустойчивые споры эндогенным путем (внутриклеточно), относятся к семейству Bacillaceae. Спорообрана 3 рода: клостридиум (Clostricdium), десульфотомакулум (Desulfotomaculum) и бациллюс (Bacillus).
Анаэробные спорообразующие бактерии. Роды клостридиум (CLOSTRIDIUM) и десульфотомакулум (DESULFOTOMACULUM)
Анаэробные микроорганизмы были открыты великим французским ученым Луи Пастером в 1861 году. В то время открытие анаэробов было ошеломляющим для ученых-биологов, полагавших, что жизнь невозможна без дыхания и использования кислорода. Утверждение о существовании анаэробных организмов показалось настолько фантастичным современникам Пастера, что они выступили против него с резкими возражениями. Это свидетельствует о том, насколько смелой, новой была для биологов XIX в. идея о существовании организмов, не нуждающихся для развития в молекулярном кислороде.
После этого события коренным образом изменились представления о разнообразии организации живых существ и энергетических основах жизни. Последующие исследования многих микробиологов показали, что самые различные природные среды, в том числе полностью лишенные молекулярного кислорода, населены множеством микроскопических организмов, принимающих самое активное участие в круговороте веществ на Земле. Кроме того, было обнаружено, что анаэробы могут быть возбудителями ряда опасных инфекционных заболеваний человека и животных. Глубокое изучение обмена веществ анаэробов позволило использовать их в промышленности как продуцентов ряда ценных для народного хозяйства соединений.
Первой анаэробной бактерией, открытой Луи Пастером, была клостридиум бутирикум (С1оstridium butyricum) — спороносная палочка, вызывающая маслянокислое брожение углеводов. В дальнейшем оказалось, что спорообра-зующие анаэробы — не какие-нибудь редко встречающиеся диковинки, а очень широко распространенные по всей поверхности Земли организмы. Вместе с неспороносными формами они составляют большой и удивительно интересный мир анаэробных микроорганизмов, обнимающий почти всю область микробиологии с ее биохимическим и морфологическим разнообразием бактерий. Действительно, анаэробы встречаются почти среди всех известных крупных систематических групп спорообразующих и неспорообразующих форм эубактерий, кокков, хламидобактерий, микобактерий и актиномице-тов, вибрионов, спирилл и спирохет. В последнем определителе (1967) французского ученого , порядки и классы бактерий и актиномицетов.
В данной главе рассказано о спорообразующих анаэробных бактериях, и только об облигатных, т. е. таких организмах, которые не способны развиваться в аэробных условиях, в отличие от факультативных, способных жить как за счет дыхания, используя молекулярный кислород, так и за счет «нитратного дыхания» либо брожения различных органических веществ в -анаэробных условиях. Необходимо отметить, что анаэробные спороносные бактерии хуже" изучены, чем аэробные, из-за значительных трудностей, с которыми встречаются исследователи при выделении и культивировании анаэробов.
Главным условием для проведения точных экспериментов по физиологии, биохимии, цитологии и генетике микроорганизмов является выделение чистых культур. Получить чистую культуру анаэробов очень сложно. В последнее время были созданы специальные приборы — анаэростаты, в которых микроорганизмы можно культивировать на плотных питательных средах в атмосфере, почти полностью лишенной кислорода. Но и при использовании современных приборов и средств выделение и инкубирование чистых культур с высокой степенью анаэробности является крайне трудным делом. Поэтому, вероятно, подавляющее большинство, например, сульфатредуцирующих, цел-люлозолитических и других спороносных анаэробов остаются до сих пор неизвестными. По существу, из этих физиологических групп, широко распространенных в природе, в лабораториях получены лишь единичные культуры.
Колонии анаэробов на агаризованных средах могут иметь самую различную форму, величину и окраску. На рисунке 37 показаны колонии одной из культур анаэробных бактерий -Clostridium sporopenitum. Так выглядят колонии под лупой. А в микроскопе при большом увеличении видно, что колонии состоят из скоплений громадного количества палочковидных клеток бактерий (рис. 38). Вся колония не поместилась в поле зрения, и виден только ее волнистый край. «Штабеля» клеток как бы текут, расползаясь по поверхности питательной среды.
Строение клеток спорообразующих анаэробных бактерий
Все анаэробы, образующие споры, имеют довольно крупные палочковидные клетки с закругленными, заостренными, а иногда как бы обрубленными концами. Величина их варьирует в среднем от 2 — 3 до 7—8 мкм в длину и 0,4—1 мкм в толщину. Среди спорообразую-щих анаэробов встречаются и гиганты (рис. 39, 40), вегетативные клетки которых достигают 15—30 мкм в длину и 1,5—2,5 мкм в толщину. Такие крупные анаэробы часто встречаются в различных природных субстратах, но выделить и вырастить их в лаборатории чрезвычайно трудно. Одну из таких бактерий удалось получить в чистой культуре сотрудникам кафедры биологии почв Московского университета. Эта культура явилась превосходным объектом для цитологических наблюдений, т. е. изучения тонкого строения клеток в процессе их роста, деления и спорообразования.
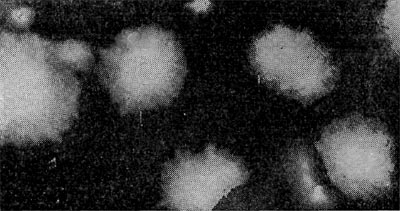
Рис. 37. Колонии Cl. sporopenitum. На темном фоне среды они имеют вид белых платочков с изрезанными краями и муаровой поверхностью. Увел. X 4.
Другие, еще более крупные двуспоровые анаэробы, обитающие в кишечнике головастиков, до сих пор не удалось получить в лабораторных условиях ни в виде чистых, ни в накопительных культурах.
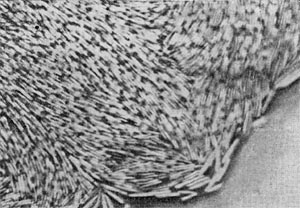
Рис. 38. Край колонии Cl. sporopenitum под микроскопом. Видны скопления клеток в виде «штабелей». Палочковидные клетки расположены радиально: длинной осью они направлены к центру колонии. Увел. X 300.
Вегетативные клетки у большинства видов анаэробов прямые, у меньшей части изогнутые в виде запятой или даже свернутые в калачики — тороиды (рис. 41). У одних видов клетки располагаются поодиночно, у других соединены в цепочки. Подвижные спорообразующие анаэробы обладают многочисленными перитрихиально (по всей клетке) расположенными жгутиками. Но имеются и неподвижные виды, лишенные жгутиков.
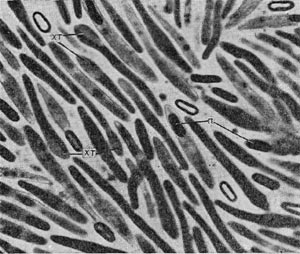
Рис. 39. Живые клетки Cl. sporopeuitum. Видно образование хроматгшовых тяжей и проспор. XT хроматиновые тяжи, П — проспоры. Увел. X 2000.
Капсулы вокруг клеток (рис. 42) имеются у некоторых патогенных (болезнетворных) и сапрофитных анаэробов. Вещество капсул состоит из выделяемых клетками специфических полисахаридов. Размер капсул часто в 2—3 раза превышает диаметр вегетативных клеток.
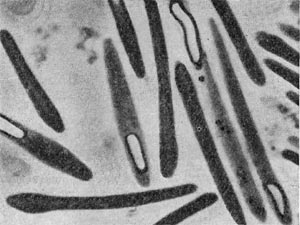
Рис. 40. Созревание спор у Cl. sporopenitum. Форма спор цилиндрическая. Увел. X 3200.
Клеточные стенки.
У анаэробных спороносных бактерий состав и строение клеточной стенки в основном такие же, как и у других грамположительных бактерий. При изучении под электронным микроскопом сверхтонких срезов клеток видно, что клеточные стенки представляют собой самый внешний слой клетки, состоящий из гранулярного и фибриллярного материала (рис. 43).
По толщине клеточные стенки варьируют у разных видов от 200—300 А до 300—400 А. Чаще всего у спорообразующих анаэробов они однослойные, но встречаются виды, у которых стенки разделены на несколько чередующихся светлых (прозрачных) и темных (электронно-плотных) слоев. Самый верхний слой стенки у некоторых плектридиальных форм имеет упорядоченную кристаллоподобную структуру и состоит из очень мелких субъединиц, расположенных в «шахматном порядке» (рис. 44).
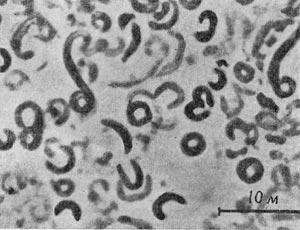
Рис. 41. Вегетативные клеткп в виде вибрионов, торондов и спирилл у Desulfotomaculum sp. (сульфатредуцпрующая бактерия). Увел. X 2100.
Мембранные системы клеток анаэробов имеют строение, аналогичное описанному в главе «Строение и химический состав бактериальной клетки». У анаэробов, как и у аэробов, мезосомы (разрастания мембраны внутрь клетки) связаны с ДНК, участвуя, очевидно, в делении нуклеоида (аналога ядра). При спорообразовании мезосомы участвуют в образовании септы (поперечная перегородка) (табл. 32 и 33).
Ядро.
Анаэробы, как и другие бактерии, лишены настоящего ядра, окруженного мембраной и обладающего набором хромосом, ядрышком и ядерным соком. Вместо этого имеется аналог ядра — нуклеоид. Часто нуклеоид называют просто ДНК-содержащей плазмой (рис. 43).
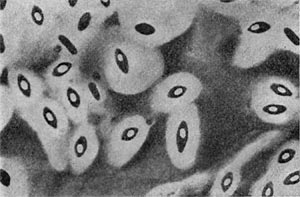
Рис. 42. Капсулы вокруг клеток Clostridium. Увел. X 2200.
Цитоплазма анаэробов имеет состав и строение, аналогичное цитоплазме аэробов. В цитоплазме некоторых анаэробов содержатся включения запасного питательного вещества гранулезы — крахмалоподобного полисахарида. При окраске йодом в растворе Люголя гранулеза приобретает синеватую или буро-коричневую окраску. На ультратонких срезах это вещество можно увидеть в форме светлых шаровидных включений (рис. 45). Липидные тельца (капли поли-в-оксимасляной кислоты) в цитоплазме облигатных анаэробов встречаются редко.
Спорообразование у анаэробных бактерий
Споры представляют собой специфическим образом устроенные покоящиеся зародышевые клетки, выдерживающие влияние высокой температуры, радиации, вакуума, различного рода токсических веществ и других неблагоприятных факторов, приводящих к гибели вегетативные клетки.
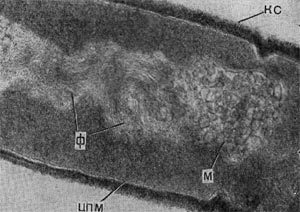
Рис. 43. Ультратонкпй срез клеток Clostridium penicillum. Видны клеточная стенка (КС), нуклеопд со спирально закрученными фибриллами ДНК(Ф), связанные с нуклеоидом мезосомы (М), п цптоплазматическая мембрана (ЦПМ).
Секрет их необычной устойчивости давно интригует ученых, и в последние годы во многих странах развернулись интенсивные исследования процесса спорообразования.
Рис. 44. Ультраструктура клеточной стенки у Clostridium sp. Увел. X 45 000.
Бактериальные споры образуются эндогенно, т. е. внутри материнских вегетативных клеток. Что заставляет бактерии перейти от вегетативного размножения к спорообразованию? Формирование спор наступает на определенной стадии развития в тот момент, когда в среде исчерпываются пищевые ресурсы (прежде всего источники углерода и азота) и происходит накопление токсичных продуктов обмена веществ. Каков же конкретный пусковой механизм, включающий процесс спорообразования? На этот вопрос ответа пока нет.
Основное назначение спорообразования перевести культуру в покоящееся (анабиотическое) состояние. Действительно, у зрелых спор обмен веществ находится на крайне низком уровне. Это позволяет бактериям сохраниться при неблагоприятных условиях среды, а при изменении условий в благоприятную сторону снова перейти к вегетативному росту. Для анаэробов (особенно почвенных) крайне важно также, что споры не чувствительны к кислороду. Это позволяет им выжить в аэробных условиях, губительно действующих на вегетативные клетки. Способность бактерий образовывать споры позволяет им оставаться жизнеспособными в течение десятков и сотен лет. Жизнеспособные споры были выделены из египетских мумий, трупов мамонтов и других объектов, где они провели века и тысячелетия.
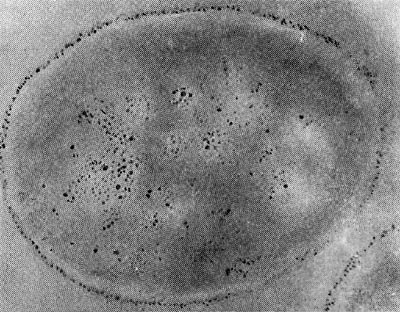
Рис. 45. Включения гранулезы в клетках Clostridium taeniosporum. «Окраска» полисахаридов серебром. От ложения зерен серебра видны в светлых шаровидных включениях и в клеточной стенке. Увел. X 45 000.
Таким образом, споры служат целям сохранения вида.
Цитология спорообразования
Молодые интенсивно делящиеся клетки анаэробов содержат нуклеоиды в виде гантелек, или V-образных фигур (рис. 46). Перед спорообразованием деление клеток прекращается, они резко увеличиваются в размерах. В это время происходит накопление большого количества запасного питательного вещества — гранулезы, — откладывающегося в виде гранул, из-за чего цитоплазма становится зернистой, а сами клетки раздуваются, принимая вид лимона (клостри-дии) (рис. 47—49) либо барабанной палочки (плектридии) (рис. 50, 51). Лишь у части протеолитических анаэробов клетки не меняют своего первоначального вида, сохраняя обычную палочковидную (бациллярную) форму (рис. 52).
Первым признаком наступления спорообразования является изменение морфологии ну-клеоидов, принимающих вид шаровидных телец. Далее несколько нуклеоидов сближаются на одном из полюсов клетки, сливаются и образуют продольно расположенный извитый хроматиновый (ядерный) тяж (рис. 53, 54 и схема 1 на табл. 32).
Зона цитоплазмы, в которой расположен ядерный тяж, превращается далее в п р о-спору. У бактерий с мелкими клетками перед спорообразованием имеются обычно 2 отдельных нуклеоида, которые сливаются с образованием осевой хроматиновой нити. Впоследствии только часть этой нити переходит в спору. Третий тип поведения ядра встречается у многих сахаролитических анаэробов. Ядерное вещество у них имеет вид хроматиновой сеточки, расположенной по всей цитоплазме. Часть этой сеточки стягивается на одном из полюсов клетки с образованием тяжа — центра формирующейся просторы. С помощью обычного микроскопа можно выделить три стадии формирования споры. Первая — возникновение на одном из полюсов клетки спо-рогенной зоны, в которой хорошо заметно ядерное вещество в виде светлых палочек (рис. 39). Вторая — спорогенная зона превращается в темную (оптически плотную) овальной формы проспору с четко выраженными контурами. В проспорах ядерное вещество уже не выявляется без применения специальных методов (окрашивание). Третья — проспоры постепенно светлеют, приобретая способность сильно преломлять свет, и теряют способность окрашиваться красителями. Созревшие споры выглядят светлыми, резко преломляющими свет тельцами, обладающими мощной оболочкой (рис. 40). Форма зрелых спор может быть различной у разных видов анаэробов: сферическая, овальная, яйцевидная, цилиндрическая.
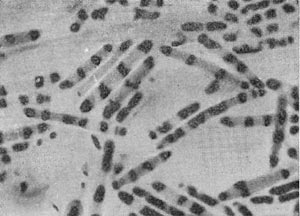
Рис. 46. Молодые, интенсивно делящиеся клетки С1оstridium sporopenitum. Видны делящиеся нуклеоиды. Окраска ядерного вещества по методу Романовского — Гимза. Увел. X 3500.
В люминесцентном микроскопе при окраске акридиновым оранжевым (люминесцирующий краситель) наблюдается многокрасочное изображение. Вегетативные клетки светятся (люминесцируют) слабым зеленоватым светом. Их ядра ярко люминесцируют зеленым светом (табл. 32, схема 1). Ядерные тяжи в спорогенной зоне сначала зеленые, затем окружаются веществом с красной флюоресценцией. Далее флюоресцирующая красная зона принимает овальную форму, а хроматиновый, расположенный в центре тяж светится желтым светом. При созревании спора резко меняет цвет и начинает светиться ярким зеленым светом. У зрелых спор с хорошо выраженным кортексом (корой) сердцевина споры темная, зеленым светится только оболочка. Меняется также и цвет цитоплазмы материнской клетки (спорангия). Сначала она слабо-зеленого цвета, затем, с момента оформления проспоры, начинает светиться оранжевым светом.
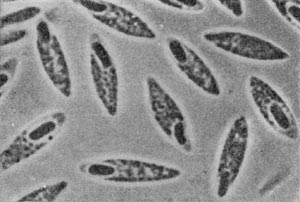
Рис. 47. Клострнднальная форма клеток Clostridium butyricum. Увел. X 3500.
Хроматиновое вещество сначала выглядит в виде компактных шаровидных гранул, а при созревании проспоры заметно разрушение нуклеоидов.
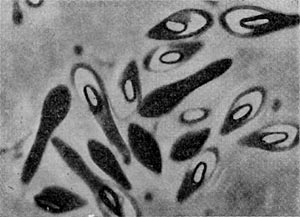
Рис. 48. Клостридиальная форма клеток. Споры снабжены светлыми конусовидными колпачками. Clostridium species, шт. 1. Увел. X 3500.
Биологическое значение слияния ядерного вещества перед спорообразованием остается неясным. Слияние хроматина наблюдается и у неспорулирующих вегетативных клеток под влиянием антибиотиков, низкой температуры, высоких концентраций солей и т. д. Во всех этих случаях, как и при спорообразовании, происходит остановка или резкое снижение синтеза ДНК. Отсюда некоторые исследователи делают вывод об отсутствии специфического значения слияния ядерного вещества перед спорообразованием. Другие авторы считают, что подобное поведение ядра имеет определенный генетический смысл. Интересно, что не только цитологические, но и химические анализы также свидетельствуют о необычном поведении ДНК при спорообразовании. Например, в спорах анаэробов нуклеотидный состав ДНК смещается по сравнению с ДНК вегетативных клеток в сторону ГЦ-типа (ДНК в спорах более «богата» такими основаниями, как гуанин и цитозин). Для спорообразующих аэробов, кроме того, показано, что около 40% высокополимерной ДНК перед спорообразованием выделяется из клеток в среду (редукция части хроматина).
Электронная микроскопия с ее высокой разрешающей способностью открывает много новых деталей процесса спорообразования. Нужно иметь в виду, что принципы формирования изображения в электронном и обычном световом микроскопе значительно отличаются: в обычном используется видимый свет (фотоны), а в электронном — поток отрицательно заряженных частиц — электронов.
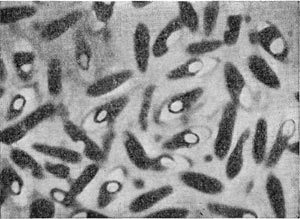
Рис. 49. Клострпдиальная форма клеток при спорообразовании. Споры со светлыми конусовидными колпачками. Clostridium sp. Увел. X 3500.
Эти различия необходимо учитывать, чтобы правильно оценивать электронно-микроскопические снимки. В обычном микроскопе изображение создается главным образом за счет различий в степени поглощения света разными участками исследуемого объекта, в электронном — в основном за счет рассеяния объектом электронов. Проходя через объект, электроны сталкиваются с атомными ядрами, рассеиваются и задерживаются. Только та часть электронов, которая беспрепятственно пройдет через объект и попадет на флюоресцирующую пластинку (экран микроскопа), сможет создать изображение. Те места на экране, куда попадут электроны, будут светиться. То есть участки клеток, сильно рассеивающие электроны, будут выглядеть на экране .темными, а участки, слабо рассеивающие электроны,— светлыми.
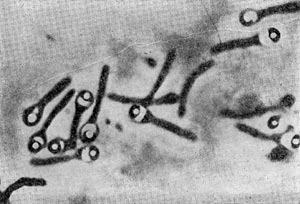
Рис. 50. Плектриндиальная форма клеток при спорообразовании. Споры с серповидными колпачками. Clostridium sp. Увел. X 3500.
Биологические объекты (клетки) состоят из веществ, построенных главным образом из легких элементов (С, N, О, Н, Р, S и др.), поэтому их изображение в электронном микроскопе слабо контрастно — в клетках можно увидеть очень мало структурных деталей. При использовании светового микроскопа это затруднение преодолевается при помощи окрашивания (контрастирования) объектов различными красителями. В электронном микроскопе изображение одноцветное. Чтобы сделать изображение более контрастным, клетки обрабатывают солями тяжелых металлов (свинца, ртути, хрома, урана, вольфрама). Так как атомы тяжелых металлов очень сильно рассеивают электроны, то структуры клетки, поглотившие эти металлы, будут выглядеть темными и контрастными. Соли тяжелых металлов или их окислы принято теперь называть электронными красителями.
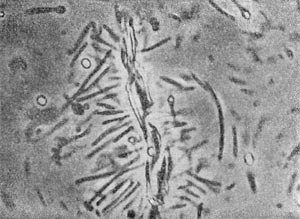
Рис. 51. Плектридтти, адсорбированные на целлюлозном волокне. (Клетчаткоразрушающне бактерии.) Увел. X 3500.
Электронную микроскопию в настоящее время нельзя рассматривать только как более утонченный морфологический метод, так как при описании электронно-микроскопических изображений цитологи неизбежно переходят с описания формы на язык химии и физической химии и пытаются объяснить на молекулярном уровне строение и функцию тех или иных структур клетки. Поэтому морфология, «спустившись на субмикроскопический уровень, органически срастается с биохимией и физиологией клетки» (Г. М. Франк).
Целые клетки из-за своей большой толщины непрозрачны для пучка электронов. Поэтому, чтобы выявить внутреннюю структуру, бактериальную клетку разрезают на десятки и даже сотни отдельных ломтиков (срезов) толщиной всего 200—600 А. Далее эти срезы просматривают в микроскопе.
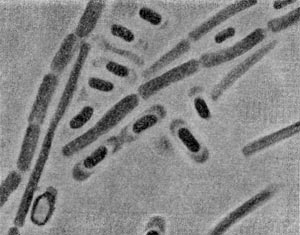
Рис. 52. Бациллярный тип спорообразования у С1оstridium sporopenatum. Увел. X 3500.
Электронно-микроскопические исследования ультратонких срезов спорулирующих клеток бактерий показали, что формирование проспо-ры начинается с инвагинации (врастания) цитоплазматическоп мембраны ближе к одному из полюсов клетки (схема 2 на табл. 32). При этом мембрана продвигается к центру клетки, и полюса ее сливаются с образованием споровой перегородки (септы). В этом процессе участвуют мезосомы, которые как бы спаивают сближающиеся участки инвагинированных мембран (рис. 1 на табл. 33). Септа состоит из двух элементарных мембран. На этом заканчивается вторая стадия спорообразования (если за первую принять образование хроматинового тяжа). Эту стадию можно рассматривать как модифицированное клеточное деление, которое, как известно, также происходит благодаря инвагинации цитоплаз-матической мембраны и образования септы.
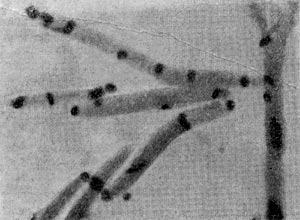
Рис. 53. Слияние нуклеоидов на полюсах клеток (перед спорообразованием). Clostridium sporopenitum. Увел. X 3500.
Следующей стадией является процесс «поглощения» материнской клеткой септированного (отсеченного) участка цитоплазмы с ядром. Этот процесс осуществляется путем роста и продвижения периферических участков мембраны материнской клетки по направлению к полюсу клетки. Затем сближающиеся участки мембраны сливаются и образуется проспора, обладающая двумя элементарными (трехслойными) мембранами — внутренней и внешней (рис. 2 на табл. 33). У одних видов проспора остается в дальнейшем у полюса клетки (терминальное расположение), у других она перемещается внутрь цитоплазмы, занимая центральное либо субтерминальное положение. Таким образом, в конце этой стадии образуется своеобразный двуклеточный организм: внутри цитоплазмы материнской клетки возникает новая клетка — проспора, окруженная, в отличие от материнской, двумя элементарными мембранами. С этого момента начинается новая необратимая фаза развития и метаболизма, заканчивающаяся созреванием споры и гибелью материнской клетки.
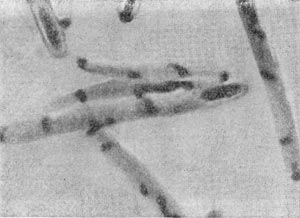
Рис. 54. Образование ядерных тяжей в процессе спорообразования. Clostridium sporopenilum. Увел. X 3500.
Интересно, что, в отличие от четвертой, вторая и частично третья стадии спорообразования обладают еще свойством обратимости. Так, если после образования септы добавить к спорулирующей культуре антибиотик хлорамфеникол, то синтез белков (а значит, и рост мембраны) будет подавлен. Движение периферических участков мембраны, поглощающей отсеченный участок протопласта, будет остановлено. В результате начавшийся процесс спорообразования превратится в обычный процесс вегетативного деления клеток, и между двумя мембранами септы отложится материал клеточной стенки (рис. 55), чего не бывает при нормальном течении спорообразования. Считается, что на четвертой стадии споруляции происходит образование кортикального слоя (кор-текса) между внутренней и внешней мембранами проспоры. Сначала кортекс появляется в виде тонкого темного слоя, сходного по структуре и плотности с клеточной стенкой вегетативной клетки. Затем этот слой резко увеличивается в толщине за счет образования более электронно-прозрачного (светлого) слоя (рис. 2—5 на табл. 33).
На пятой стадии закладывается оболочка споры. Вначале вокруг проспоры на некотором расстоянии от внешней мембраны проспоры в цитоплазме материнской клетки возникают участки темного (электронно-плотного) вещества в виде чешуек. На шестой стадии отдельные листки оболочки удлиняются и, в конце концов, сливаются, образуя сплошной непрерывный плотный слой. Между этим слоем и внешней мембраной проспоры остается отсеченный слой цитоплазмы вегетативной клетки. Поверх первого слоя оболочки может закладываться еще один или два слоя. В этом случае они разделяются на внутренний, средний и внешний слои оболочки. Эти слои различаются между собой по структуре. У некоторых видов внутренний слой оболочки является пластинчатым, а внешний имеет вид плотного толстого слоя. У других видов, наоборот, пластинчатый слой может быть внешним, а более плотный слой — внутренним. Если строение сердцевины очень сходно у разных видов, то строение оболочек спор у них сильно различается как по тонкому строению, так и по количеству и толщине слоев (рис. 56).
После окончательного созревания споры происходит лизис материнской вегетативной клетки — клеточная стенка разрушается, и спора выходит в среду (седьмая стадия).
У многих видов анаэробов поверх споровой оболочки обнаруживается еще одна структура — экзоспориум. Он имеет вид чехла, в котором расположена спора (рис. 57). Тонкое строение экзоспориума весьма различно у разных видов (рис. 56). Часто он очень многослоен, например у Clostridium pasteurianum, Cl. bifermentans, Cl. tyrobutyricum и др. В экзоспориуме многих видов анаэробов обнаруживаются слои с упорядоченно расположенными субъединицами. На рисунке 58 показана тонкая структура пластинчатого слоя экзоспориума. Шаровидные субъединицы в этом слое имеют гексагональную упаковку. Иногда рядом расположенные субъединицы сливаются, образуя кольцевидные структуры с порами в центре. Такие слои экзоспориума представляют собой перфорированные пленки-мембраны. Возникает экзоспориум на ранней стадии формирования споры в виде небольшого пузырька на внешней мембране проспоры. Этот пузырек разрастается, превращаясь в чехол, охватывающий спору со всех сторон.
У анаэробов этот чехол не цельный, имеет крупные поры. Иногда через эти поры в цитоплазму спорангия проходят трубчатые выросты споровой оболочки.
Химический состав и роль споровых структур. Сердцевина споры, окруженная слоем кортекса, представляет собой протопласт с собственной мембраной, ядром и цитоплазмой (схема 3 на табл. 32). Сердцевина у зрелых спор является покоящейся вегетативной клеткой. Она характеризуется очень низким уровнем метаболизма. Хотя в ней имеются все необходимые ферменты, их активность каким-то образом подавлена.
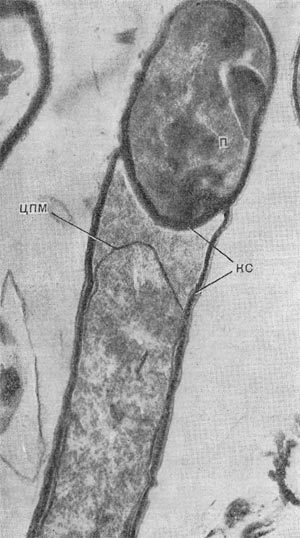
Рис. 55. Влияние хлорамфеникола (антибиотика, подавляющего синтез белка) на спорообразование. Остановка на стадии образования септы п превращение спорообразования в процесс вегетативного деления клеток. Увел. X 66 000. Clostridium penicillum. П — проспора, ЦПМ — цитоплазматическая мембрана, КС — клеточная стенка. Увел, х 66 000.
Кортекс (схема 3 на табл. 32) состоит из мукопептидов, весьма сходных с мукопептида-ми клеточных стенок. В кортексе содержится также диаминопимелиновая кислота. Внутренняя плотная часть кортекса, прилегающая к мембране сердцевины, при прорастании спор оформляется в клеточную стенку молодой вегетативной клетки. В спорах обнаруживается в довольно больших количествах дипиколино-вая кислота (C7H5O4N) — активный хелирующий агент, соединение, образующее клешневидные комплексы с металлами. Это вещество отсутствует в вегетативных клетках. Из спор дипи-колиновая кислота выделяется в виде кальциевой и магниевой солей, играющих большую роль в термоустойчивости спор. Хорошо известно, что споры способны выдерживать высокие температуры и не погибают даже при кипячении. Имеются также доказательства того, что дипиколиновая кислота играет центральную роль в процессе перевода протопласта споры в покоящееся состояние. Но механизм этих явлений не выяснен. Предполагается, что дипиколиновая кислота локализована в кортексе, так как имеется определенная корреляция между образованием кортекса и накоплением в споре дипиколиновой кислоты и кальция. С другой стороны, при разрушении кортекса (в процессе прорастания или механическом разрушении спор) дипиколиновая кислота обязательно переходит в раствор.
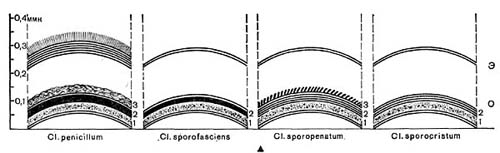
Рис. 56. (Схема.) Строение оболочки спор у различных видов анаэробных бактерий: Э — экзоспориум, О — оболочка споры. 1, 2, 3 — слои споровой оболочки.
Кортекс у зрелых спор, очевидно, играет защитную роль. Он предохраняет сердцевину от литических ферментов, разрушающих клетки. Это предположение подтверждается экспериментами с мутантами, у которых потеряна способность к формированию кортекса. На завершающей стадии спорообразования происходит резкое возрастание активности литических ферментов, полностью разрушающих материнскую вегетативную клетку. Лишенные кортекса споры при этом также лизируются.
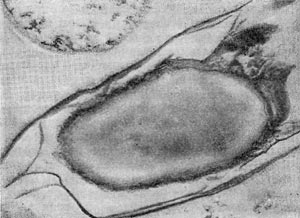
Рис. 57. Зрелая спора Clostridium penicillum. Сердцевина выглядит бесструктурной. Видны многослойный экзоспорпум п выросты на оболочке споры. Увел. X 45 000.
Оболочка (или покровы) является уникальной структурой бактериальных спор, не встречающейся у других микроорганизмов (схема 3 на табл. 32). Она в основном состоит из белковых веществ, обогащенных цистином. Объем оболочки достигает 50% от всего объема споры. Вещество споровых оболочек не чувствительно к действию различных литических ферментов. Специфическая для каждого вида бактерий форма спор сохраняется благодаря структурной ригидности оболочек. Оболочка играет также роль защитной структуры, предохраняющей споры от преждевременного прорастания. Споры мутантных штаммов, лишенные оболочек, обычно прорастают непосредственно после выхода из спорангиев в неблагоприятной для роста среде (даже в дистиллированной воде), что приводит к гибели проросшие клетки. Однако роль оболочек спор, так же как и кортекса. остается во многом еще загадочной.

Рис. 58. Тонкая структура экзоспориума у Clostridium bifermentans. Видны отдельные светлые субъединицы и гексагональные «плитки». Увел. X 384 000.
Экзоспориум представляет собой мембрано-видную, часто многослойную структуру. Химический состав экзоспориума проанализирован лишь у одной аэробной культуры. О составе экзоспориума у анаэробов данных в литературе нет. Предполагается, что экзоспориум играет роль барьера, регулирующего проникновение различных веществ в спору. В этом отношении необъясненным остается тот факт, что у многих анаэробных бактерий экзоспориум не представляет собой замкнутой системы: в его полярной части, погруженной в цитоплазму материнской клетки, имеются очень крупные поры, или отверстия, диаметром до 0,5 мкм. Некоторые авторы предполагают, что экзоспориум участвует в формировании споровых оболочек. После механического удаления экзоспориума споры остаются нормальными, процесс прорастания у них не нарушается. Роль экзоспориума продолжает оставаться загадкой.
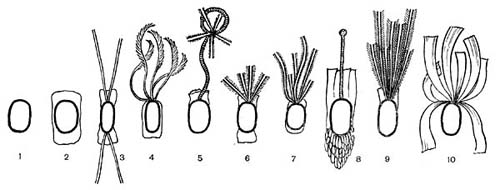
Рис. 59. Строение поверхностных структур спор некоторых анаэробных бактерий: Споры без выростов и экзоспориума: 1 — Clostridium felsincum. Споры с экзоспориумом в, виде чехла: 2 — Cl. pasteurianum. Споры с выростами различных типов и экзоспориумом: 3 — Cl. sporosetosum; 4 — Cl. sporopenatum; s — Cl. saprogenes; 6 — Cl. sporofasciens; 7 — Cl. sartagoformuin; s — Cl. corinoforum; 9 — Cl. penicillum. Споры с лентовидными выростами, но без экзоспориума: 10 — Cl. taeniosporum.
Выросты на спорах. Замечательной особенностью спорообразования у анаэробов является формирование на спорах особых выростов с поразительно разнообразной структурой. Каждому виду анаэробных бактерий свойствен свой тип строения выростов (рис. 59). Этот признак строго специфичен, наследственно закреплен и очень устойчив. Даже у дефектных спор, потерявших способность образовывать оболочку, выросты сохраняются и не меняют своей специфической структуры.
Поражает разнообразие выростов у различных видов анаэробных бактерий. Они могут иметь форму метелок, тонких нитей или жгутиков, трубок различной толщины, разбросанных по всей поверхности споры или собранных в пучок ершиковидных палочек, длинных широких лент, шипов, булавок и образований, сходных по форме с оленьими рогами (табл. 34).
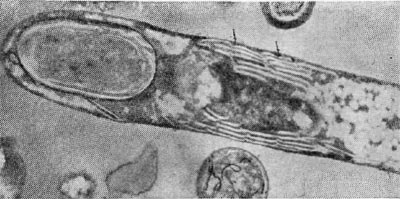
Рис. 60. Ультратонкий срез клеток Cl. taeniosporum. Реакция на дегидрогеназы. Стрелками показаны отложения теллура. Видны выросты п светлые шаровидные включения гранулезы. Увел. X 45 000.
У Clostridium taeniosporum выросты имеют лентовидную форму. Пучок таких отростков прикрепляется к споре с помощью специального органа — подушечки (схема 3 на табл. 32 и рис. 4 на табл. 35). Выросты появляются на ранней стадии формирования проспоры - перед закладкой кортекса и оболочки; затем они растут, удлиняются, пронизывая цитоплазму, пока не достигнут противоположного полюса клетки. Цитоплазма вокруг выростов постепенно лизируется (рис. 61). Материнская клетка разрушается. На свободных зрелых cпорах, вышедших из спорангия, выросты распускаются в виде зонтика (рис. 3 на табл. 34).
Рис. 61. Поперечный ультратонкнй срез клеток С1. penicillum. Хорошо заметен лизис цитоплазмы вокруг трубчатых выростов (светлые зоны). Увел. X 96 000.
На спорах Clostridium saprogenes имеется по одному крупному и сложноустроенному выросту (табл. 35). Он имеет вид длинного толстого жгута-ствола, образующего на конце кольцо, от которого отходят усики — трубчатые палочковидные отростки. Ствол имеет грубозернистую структуру и поперечную исчер-ченность, мелкозернистые усики обладают кап-сулярным слоем. Формирование выростов у этого вида можно проследить на целых клетках. Сначала отростки плохо просматриваются, так как они окружены плотными участками цитоплазмы (рис. 1 на табл. 35), затем цитоплазма осветляется и выросты становятся хорошо заметными (рис. 2 на табл. 35). На одном из полюсов клетки четко заметна кольцевидная структура и усики.
Рис. 62. Ячеистые колпачки на спорах. Видны отдельные газовые вакуоли (мешочки), составляющие колпачок. Cl. caliptrosporum. Увел. X 55 000.
Следующая стадия — лизис материнской клетки и выход зрелой споры в среду (рис. 3 на табл. 35). У организма, описанного как Bacillus (Clostridium) penicillus (строгий анаэроб), выросты имеют вид пучка толстых трубок, прикрепленных к одному из полюсов споры (рис. 1 на табл. 34). На поперечных срезах спорулирующих клеток четко видны зоны лизиса цитоплазмы вокруг выростов, имеющих вид овальных плотных телец с зернистой структурой (рис. 61).
Химической состав и роль выростов на спорах.
Сложные по строению отростки на спорах впервые были обнаружены сотрудниками кафедры биологии почв Московского университета. В настоящее время выросты на спорах анаэробов изучаются также во многих лабораториях за рубежом. Описываются новые виды отростков. Наиболее интересным является вопрос о функции (биологической роли) этих споровых структур. Выяснение функции тех или иных клеточных структур — отнюдь не легкое дело. В истории биологии найдется немало примеров тому, что выяснение роли той или иной клеточной структуры занимает много лет (а иногда и десятилетий). Подобные исследования очень увлекательны и имеют большое значение: с каждой новой структурой открываются новые вещества, особые ферменты, нередко совершенно неизвестные биохимические процессы.

Таблица 34. Спорообразующие анаэробные бактерии: 1 — Clostridium penicillum, трубчатые выросты на спорах; 2 — Cl. sporotrichum, жгутиковидные отростки на спорах; 3 — Cl. taeniosporum, лентовидные выросты на спорах; 4 — Cl. sporopenatum, перистые выросты на спорах; 5 — Cl. sartagoformum, трубчатые выросты на спорах; 6 — Clostridium sp., споры с шипами на поверхности оболочки.
Функция выростов на спорах окончательно еще не выяснена. Одни исследователи предполагают, что отростки на спорах — специфические чувствительные (хемосенсорные) органел-лы, подающие споре «команду» на прорастание (при благоприятных условиях). Другие считают, что выросты выполняют важную роль в процессе созревания спор, участвуя в формировании споровых покровов и кортекса. Третьи допускают, что выросты на спорах — результат каких-то нарушений в нормальном обмене веществ.
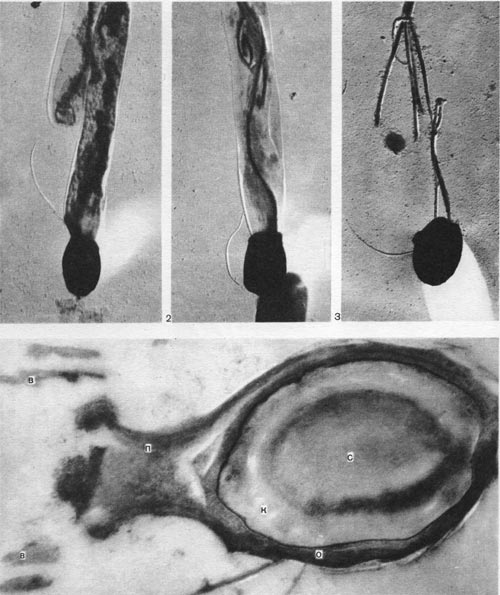
Таблица 35. Спорообразующие анаэробные бактерии: 7, 2, 3, — Clostridium saprogenes, выросты в виде султана, разветвляющегося на конце. Видны стадии формирования споры и выростов, заканчивающиеся лизисом клетки и освобождением споры (1, 2 — увел, х 10 800; 5 -— увел, х 15 000); 4 — Cl. taeniosporum, срез споры с лентовидными выростами; видна подушечка, прикрепляющая выросты к споре: п — подушечка, в — выросты, с — сердцевина споры, о — оболочка, к — кортекс.
Химические анализы показали, что выросты состоят в основном из белка. В веществе выростов обнаружено 18 различных аминокислот, а также полисахариды и липиды. Оказалось, что по аминокислотному составу и структуре белок выростов сходен с такими белками, как кератин, актин, коллаген. Для того чтобы проделать подобные анализы, нужно было «отрезать» выросты у большого количества спор, а затем очистить от загрязняющих веществ и собрать их вместе. В качестве «ножниц» при этом был использован ультразвук, а собрать микроскопические отдельные отростки удалось с помощью современных высокоскоростных центрифуг.
Очень важным является вопрос о ферментативной активности выростов. В трубчатых выростах Bacillus penicillus выявлена дегидро-геназная активность (т. е. активность ферментов, отщепляющих водород от окисляемых субстратов).
Химический состав и тонкая структура выростов, их локализация в области контактирующих мембран двух функционально различных клеток (материнской клетки и проспоры) позволяют в общем виде заключить, что выросты бактериальных спор представляют собой специализированные структуры, которые ответственны за контакт клеток в системе спорангий — спорта.
Колпачки на спорах
Еще одной чрезвычайно интересной особенностью спорообразования у анаэробов является формирование на спорах блестящих колпачков. Эти колпачки на спорах у клостридиального и бациллярного типа клеток имеют конусовидную, а на спорах плектри-диев — серповидную форму (рис. 48—50, 62). Колпачки при наблюдении в фазово-контраст-ном микроскопе четко выделяются благодаря сильному блеску. Электронная микроскопия показывает, что они имеют ячеистое строение. Множество отдельных ячеек упакованы таким образом на споре, что образуют сотовидную структуру в виде конуса или серпа. Ячейки - это электронно-прозрачные мешочки, заполненные газообразным веществом (газовые вакуоли). Мешочки имеют палочковидную или яйцевидную форму (см. рис. 62). Назначение колпачков состоит, по-видимому, в том, чтобы увеличивать подвижность и плавучесть спор в водной среде, и тем самым способствовать их распространению в природе. Подобно понтонам ячеистые колпачки не позволяют спорам тонуть. Споры с колпачками не удается осадить даже с помощью центрифуг, более того, при центрифугировании они всплывают на поверхность.
Способностью образовывать ячеистые колпачки обладают азотфиксирующие сахаролити-ческие клостридии, сульфатредуцирующие бактерии и специфические почвенные плектридии, распространенные главным образом в почвах гидроморфного ряда.
Физиология спорообразования у анаэробов
Причины, вызывающие переход бактерий от вегетативного развития к спорообразованию, длительное время были неизвестны микробиологам. Впервые в нашей стране А. Я. Мантеифель, Н. Д. Иерусалимский провели исследования, вскрывшие факторы, влияющие на образование спор сахаролитическими анаэробами. Оказалось, что спорообразование вызывается исчезновением из среды источников азота, а также накоплением продуктов обмена (например, бутилового спирта). Но чтобы приобрести способность к споруляции, бактерии должны развиваться при нормальных условиях на полноценной питательной среде, содержащей набор аминокислот и факторов роста. Кислотность среды, оптимальная для вегетативного роста, является наиболее благоприятной и для спорообразования (рН 4,5—5,5 для Cl. acetobutylicum и ~7—7,2 для протеолитических анаэробов). Аэрация останавливает споруляцию. Эти данные свидетельствуют о том, что спорообразование является нормальной стадией развития у этих бактерий.
У анаэробов в отличие от аэробных видов исчерпание в среде источников углерода не влияет на процесс спорообразования. Даже добавление к среде глюкозы (5 г на литр) не сказывается на процессе спорообразования. Если культура выращена на полноценной питательной среде и приступила к спорообразованию, то дальнейший перевод клеток в условия полного голодания (например, перенос в водопроводную воду) не только не подавляет, но даже стимулирует споруляцию у некоторых сахаролитических анаэробов (Cl. saccharobutyricum), т. е. для спорообразования не требуется в этом случае поступления питательных веществ из внешней среды (экзогенных источников питания), а для завершения конечных этапов формирования спор используются внутриклеточные запасы. Такой обмен веществ называется эндогенным (или эндотрофным) метаболизмом. Действительно, установлено, например, что белок спор образуется за счет азота белка вегетативных клеток. Однако у протеолитических анаэробов споруля-ция не поддерживается в среде, полностью лишенной органических питательных веществ. Так, для спорообразования Cl. botulinum требуются аминокислоты — аланин и аргинин, которые используются в качестве источников энергии.
>Генетический контроль спорообразования.
Процесс «поглощения» материнской клеткой от сеченной на полюсе части цитоплазмы с ядерным элементом приводит к образованию новой клетки с двумя мембранами (проспора). Возникает особая ассоциация клеток — двуклеточ-ный организм в общей оболочке, причем одна из клеток — проспора осуществляет свою жизнедеятельность внутри цитоплазмы другой, материнской клетки. Возникает крайне интересная ситуация, где сталкивается деятельность двух генетических центров — ядра материнской клетки и ядра споры. Многие стороны в их взаимоотношениях остаются еще неясными. Но из цитологических, физиологических и генетических наблюдений можно сделать вывод, что эти два ядра «разделяют» между собой обязанности, связанные с контролем над процессами формирования споровых структур.
Рис. 63. Стадии прорастания спор Cl. sporopenitum. Увел. X 2100.
Так, синтез новых белковых веществ, споровых оболочек, кортекса и экзоспориума осуществляется при активном контроле генома материнской клетки. При этом роль материнской клетки сводится к тому, чтобы как-то отделить от себя дочернюю клетку, оказавшуюся внутри ее цитоплазмы. Но так как удалить проспору за пределы клеточных границ через цитоплазматическую мембрану и клеточную стенку невозможно, то материнская клетка поступает с дочерней по-иному — она изолирует ее от себя путем инцистирования, окружая проспору мощными слоями белковой оболочки и переводя ее в метаболически неактивное (анабиотическое) состояние. Но это все равно не спасает материнскую клетку от гибели. Хотя она и продолжает еще длительное время активно функционировать, даже иногда способна образовать еще одну спору, но все же она не в состоянии вернуться к вегетативному развитию. В результате нарушения обмена веществ в конце концов наступает лизис (разрушение) вегетативной материнской клетки и освобождение спор.
Участие в спорогенезе большого количества ферментов и антигенов, включение новых путей биосинтеза и появление новых специфических клеточных структур показывает, что число генов, контролирующих спорогенез, достаточно велико (по всей вероятности, их больше 100). Некоторые из этих генов функционируют и в период вегетативной стадии развития. До сих пор остается неясным механизм функционирования спорового генома (набора генов, ответственных за спорообразование). Установлено, что споры получают весь свой ядерный материал (ДНК) в готовом виде от материнских клеток. При этом количество ДНК на спору постоянно для данного вида и не зависит от среды выращивания бактерий. Таким образом, этот показатель, вероятно, может служить характеристикой вида и использоваться при систематике спорообразую-щих бактерий.
Прорастание спор
Споры, перенесенные в свежую питательную среду, начинают прорастать. Сначала они набухают, темнеют, затем через образовавшееся отверстие в оболочке споры молодая клетка выходит в среду. При этом слой кортекса разрушается, а споровая оболочка вместе с отростками (если таковые имеются) сбрасывается. У анаэробов проследить за прорастанием, наблюдая за одной и той же спорой, удается только в редких случаях. На рисунке 63 представлена серия фотографий, иллюстрирующих различные стадии прорастания — от потемнения сердцевины спор до выхода молодой вегетативной клетки из споровой оболочки. На последней стадии выхода вегетативная клетка как бы отстреливается. Отверстие в оболочке споры образуется не строго на полюсе споры, а несколько сбоку, и молодая вегетативная клетка при выходе расположена под углом к длинной оси споры. У других анаэробов процесс прорастания может выглядеть иначе.
Особенности прорастания Cl. pasteurianum С. Н. Виноградскии (1902) использовал для дифференциации этого вида от других спорообразующих анаэробов. Наконец, три вида клостридиев — Cl. pectinovorum, Cl. bu-tyricum и Cl. tetani — отличаются тем, что прорастание их спор происходит внутри спорангия. Клеточная стенка (или часть ее) у этих видов не лизируется, а остается на зрелых спорах, облегая их в виде чехла. Но этот чехол не идентичен по происхождению и строению с экзоспориумом, описанным выше.