Жизнь растений
Основные систематические группы бактерий и актиномицетов (3)
Строение лучистых грибков
Все высшие формы лучистых грибков имеют хорошо развитый мицелий. Толщина гиф мицелия варьирует в широких пределах в зависимости от видовой принадлежности культуры, ее возраста, условий развития. Диаметр тонких гиф 0,1 —1,0 мкм, наиболее толстых гиф — до 1,5 мкм. У актиномицетов, выращенных на плотных агаризованных средах (поверхностные культуры), различают три типа мицелия: субстратный, воздушный и надсубстратный, или колонии. Субстратный мицелий развивается в глубине среды и представляет собой как бы корневую питательную систему. Нити его всасывают питательные вещества среды и доставляют колонии, а оттуда в воздушный мицелий. Мицелий надсубстратный развивается на поверхности агаризованной среды, разрастается плотным сплетением в колонии большей или меньшей величины. На рисунке 83 показаны некоторые типы колоний актиномицетов. Колонии лучистых грибков плотные, кожистые, крепко срастающиеся со средой. Величина их зависит от вида актиномицетов и условий их роста, они могут быть мелкими — 0,5—2 мм и крупными — до I см и более. Внешний вид колоний также различен: колонии бывают с гладкой, бугристой, складчатой и зернистой поверхностью. Воздушный мицелий актиномицетов формируется на поверхности колонии. Нити его отходят от мицелия колонии, разрастаются в густую пушистую, бархатистую или мучнистую массу. Нередко воздушный мицелий развивается слабо в виде небольшого налета, а некоторые организмы и вовсе лишены его.
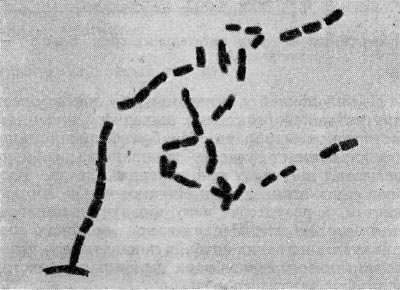 Рис. 86. Сегментацпонный способ образования спор.
Рис. 86. Сегментацпонный способ образования спор.Исследованиями последних лет было показано, что поверхность клеток воздушного мицелия отличается от поверхности субстратного мицелия. На поверхности клеток воздушного мицелия обнаружен рыхло связанный слой, построенный из очень тонких нитевидных частиц и различных фибриллярных телец. Субстратный мицелий называют первичным, а воздушный — вторичным. Есть сообщения и о том, что способность образования воздушного мицелия у актиномицетов может быть стимулирована или подавлена при добавлении в питательную среду определенных веществ.
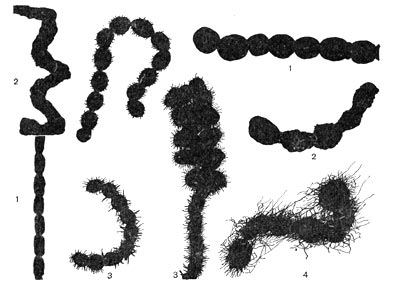 Рис. 87. Поверхность оболочки спор у актиномицетов: 1 — гладкая; 2 — бугристая; 3 — шиповидная; 4 — волосистая.
Рис. 87. Поверхность оболочки спор у актиномицетов: 1 — гладкая; 2 — бугристая; 3 — шиповидная; 4 — волосистая.Исследователи наблюдали случаи, когда естественная потеря способности формировать воздушный мицелий у некоторых актиномицетов восстанавливается при добавке в питательную среду витаминов (биотин), аминокислот (метио-нин) и других веществ.
Клетки актиномицетов состоят из нескольких основных частей. На рисунке 84 показан общий план строения клетки актиномицетов. Клетка ограничена оболочкой — стенкой, толщина которой от 0,01 до 0,03 мкм. На поверхности оболочек мицелия расположена слизистая капсула. Обычно она очень тонкая и не обнаруживается при микроскопическом анализе, но у отдельных представителей лучистых грибков наблюдается обильное, видимое простым глазом скопление слизи, которое является специфическим признаком определенных групп организмов.
Оболочка актиномицетов в целом представляет собой относительно неплотную систему. Через нее в клетку могут проникать многие химические соединения, например белок, антибиотики, аминокислоты и многие другие вещества.
Оболочка принимает участие в общем обмене веществ и образовании различных продуктов жизнедеятельности клетки — метаболитов. Оболочка построена так же, как и у грамположи-тельных бактерий, и состоит из белковых, ли-пидных, мукополисахаридных' компонентов. У отдельных групп актиномицетов в оболочках содержатся фосфорные соединения, тейхоевые кислоты, количество которых у разных представителей актиномицетов не одинаковое.
Многие исследователи пытаются подразделить организмы на группы в зависимости от химического состава оболочек. Так, американские микробиологи лучистые грибки делят на 6 групп в зависимости от содержания в оболочках разных стереоизомеров диаминопимелино-вой кислоты (ДАП), аминокислот и Сахаров. Другие ученые считают, что пока нет достаточных экспериментальных сведений, которые позволили бы делить организмы на соответствующие группы по химическому составу их оболочек. Состав оболочек, по-видимому, не может служить единственным критерием для разделения актиномицетов, так как у одной и той же группы культур в оболочках находят различные по составу компоненты.
Под оболочкой у актиномицетов, как и у всех других микроорганизмов, находится цитоплаз-матическая мембрана. Мембрана актиномицетов принимает участие в процессах обмена веществ, а также при делении клеток. Рост мембраны приводит к впячиванию ее внутрь клеток, в результате чего образуется поперечная перегородка. Исследования японских специалистов и других авторов показали, что цито-плазматическая мембрана принимает участие и в образовании спор.
Цитоплазма клетки состоит из оптически плотных скоплений различных размеров, рисунка и сложности. В цитоплазме имеется также нуклеоид, заполненный сетью переплетенных нитей ядерного вещества. Ядерное вещество не имеет мембраны и не отделено от цитоплазмы. В старых культурах цитоплазма мицелия приобретает грубозернистую структуру, распадается на отдельные комочки. Нити одной и той же культуры не равноценны по состоянию цитоплазмы и составу оболочки. В цитоплазме актиномицетов обнаружены растворимые и нерастворимые полифосфаты, полисахариды, а у отдельных культур — жировые вещества. При ультрамикроскопическом анализе клеток лучистых грибков в цитоплазме выявляются особые структуры мезосомы с тонким мембранным строением. Наблюдается связь этих структур с цитоплазматической мембраной. Эти мембранные тельца расположены или беспорядочно, или в виде концентрических колец, рыхлые либо плотно сжатые, в одних клетках их больше, в других — меньше. Во внутрицитоплазматических мембранах концентрируются окислительные ферменты.
При спорообразовании в клетках наблюдаются следующие изменения: хроматиновое вещество разделяется на комочки различной формы и величины, располагающиеся вдоль спороносной гифы, вокруг них концентрируется цитоплазма. Затем вся цитоплазма расчленяется на участки — проспоры, которые покрываются собственной оболочкой и затем превращаются в споры.
В нитях актиномицетов, кроме хроматиновых зерен, имеются гранулы волютина, который образуется и накапливается в зависимости от состава среды, условий роста и возраста культур. Появление волютиновых гранул в цитоплазме клеток актиномицетов сопровождается резким снижением антибиотической продуктивности мицелия.
Волютиновые гранулы содержат РНК и кислотонерастворимые полифосфаты. Причем состав волютина гиф разного возраста неодинаков: на ранних стадиях развития культур в волютиновых гранулах содержится большее количество РНК, на более поздних стадиях основными компонентами волютина являются полифосфаты. Волютин — не обязательный структурный элемент клеток актиномицетов. Волютиновые гранулы появляются обычно на более поздних стадиях развития культуры в условиях нарушенного баланса между отдельными компонентами питательной среды. При культивировании актиномицетов на некоторых средах (особенно при глубинном выращивании) в цитоплазме гиф появляются вакуоли в виде маленьких или крупных пузырьков. Содержимое вакуолей в молодых гифах однородное. В зрелых нитях мицелия встречаются крупные зернистые вакуоли. Предполагается, что эти вакуоли образуются из запасных веществ. Клетки мицелия представителей лучистых грибков хорошо окрашиваются основными анилиновыми красками: метиленовой синью, метиловым фиолетовым, карболовым фуксином и др.
Характерной особенностью всех лучистых грибков является их способность окрашиваться по Граму положительно. Клетки лучистых грибков устойчивы к щелочным условиям среды и действию протеолитических ферментов (трипсина, пепсина). Грамположительные формы микробов более чувствительны к действию антибиотиков, чем грамотрицательные, и менее чувствительны к реактивам: анилину, фенолу, этиловому спирту, бензолу, хлороформу и др.
У разных представителей лучистых грибков способы размножения различны. Актиномицеты имеют специальные спороносные органы - спороносцы, или спорангии. Спороносцы у актиномицетов различаются по своему строению и расположению: прямые, длинные или короткие, волнистые; спирально закрученные; число завитков от 1 до 10 и более. Завиток может быть растянутым или плотно сжатым. Расположение спороносных веток моноподиальное (последовательное), мутовчатое и пучкообразное, супротивное. В мутовках спороносные ветки могут быть прямыми и спиральными. На рисунке 83 показаны основные типы строения спороносцев актиномицетов.
Для актиномицетов характерно образование спор — конидий. Споры формируются на воздушном мицелии, в отдельных случаях — на субстратном мицелии. Отмечено два типа образования спор — фрагментационное и сегментационное.
Фрагментационный процесс характеризуется тем, что вокруг ядерных элементов, равномерно распределенных по гифе, концентрируется цитоплазма, которая покрывается собственной оболочкой и превращается в зрелую спору. Оболочка спороносных нитей некоторое время сохраняется, затем распадается, споры высыпаются и в соответствующих условиях снова прорастают, образуя гифы новых колоний актиномицетов (рис. 85). При сегментационном образовании спор наблюдается простое деление спороносных клеток. На всем протяжении ветки образуются поперечные перегородки,и спороносец расчленяется на ряд равномерных клеток — спор. Перед сегментацией в спороносящей ветке происходит деление ядерного вещества, образуется столько зерен хроматина, сколько будет спор. Вокруг хроматиновых зерен также концентрируется плазма клетки. Когда споры созревают, спороносец распадается на отдельные споры (рис. 86).
Споры актиномицетов различаются по форме. Они бывают шаровидными, цилиндрическими, палочковидными, грушевидными. У одних видов актиномицетов поверхность оболочки спор имеет шиловидную, бугристую, волосовидную структуры, у других — поверхность оболочки гладкая (рис. 87). Этот признак используется для определения принадлежности актиномицетов к той или иной группе.
По сравнению с вегетативными клетками споры обладают повышенной устойчивостью к действию неблагоприятных факторов. Так, культуры актиномицетов, высушенные до воздушно-сухого состояния, могут сохранять жизнеспособность в течение нескольких лет. Споры устойчивы и к механическому воздействию: при растирании культур в смеси с частицами песка споры не теряют жизнеспособности, тогда как соответствующие им по размеру фрагменты вегетативного мицелия погибают. Имеются сведения, что споры актиномицетов могут свободно переноситься по воздуху. Прорастание спор у лучистых грибков однотипное. На свежей питательной среде они сначала несколько разбухают, затем на поверхности появляются бугорки — почки, которые, удлиняясь, прорастают в длинные нити. Нити ветвятся, формируя мицелий — колонии лучистых грибков.
Актиномицеты могут размножаться также обрывками мицелия разной длины, от едва заметного комочка до палочковидных элементов. Культуры актиномицетов пересеваются с помощью комочков субстратного или воздушного мицелия или самой колонии. Во всех случаях вырастают нормальные клетки дочернего организма, свойственные данному виду.
Группы лучистых грибков отличаются по способу образования органов плодоношения, что служит признаком для деления их на семейства, роды.
Классификация лучистых грибков
Для систематики актиномицетов были использованы основные признаки, которыми характеризуются представители этой группы микробов. При этом учитывались данные изучения экспериментальной морфологической изменчивости различных групп антиномицетов, строение и развитие органов плодоношения, характер спороносцев, строение оболочки спор. По этим признакам лучистые грибки разбиваются на крупные таксоны. Дальнейшая дифференциация на виды основана главным образом на физиолого-биохимических свойствах лучистых грибков.
При определении видов актиномицетов учитывают их способность образовывать красящее вещество (пигменты), расти на питательных средах с определенным набором веществ, образовывать специфические вещества, как-то: антибиотики, ферменты, токсины и др. Выращивая организмы в одних и тех же условиях, можно легко выявить различия между ними, морфологическое, культуральное, физиологическое и биохимическое сходство. На рисунке 88 приведена схема классификации лучистых грибков (высшие формы). Класс Actinomycetes состоит из двух порядков. Actinoplanales — подвижные и Actinomycetales — неподвижные формы. Класс объединяет 6 семейств, в которые входят 26 родов. В таблице схематично показано, как образуются в каждом семействе, роде органы плодоношения — спорангии, споры — и чем они отличаются друг от друга.
Семейства актиномицеты (ACTINOMYCETACEAE), МИКРОМОНОСПОРОВЫЕ (MICROMONOSPORACEAE) И СТРЕПТОСПОРАНГИЕВЫЕ (STREPTOSPORANGIACEAE)
У микроорганизмов рода Actinomyces, входящих в семейство Actinomycetaceae, образование спор происходит на прямых или спирально закрученных ветках — спороносцах воздушного мицелия. Споры формируются одновременно на всем протяжении спороносца; образуются длинные цепочки, в которых содержится от 30 до 50 спор. Эта группа организмов наиболее распространенная. Характерной особенностью рода актинопикнидиум (Actinopycnidium), описанного в 1962 году, является наличие плодовых тел типа п и к н и д. Формируются они при сплетении нитей мицелия. Наружные нити мицелия образуют сплошную оболочку. Гифы внутри пикнид распадаются на короткие элементы, из которых формируются пикнидо-спо-ры. Когда оболочка пикнид разрушается, споры высыпаются наружу.
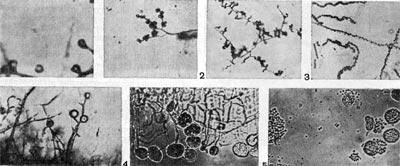 Рис. 89. Рост культур из семейств Micromonosporaceae и Streptosporangiaceae: 1 — культуры рода Micromonospora; 2 — культуры из рода Microbispora; 3 — культуры из рода Micropolyspora; 4 — формирование спорангиев у культур из рода Streptosporangium; 5 — зрелые спорангии и выход из них спор у Streptosporangium.
Рис. 89. Рост культур из семейств Micromonosporaceae и Streptosporangiaceae: 1 — культуры рода Micromonospora; 2 — культуры из рода Microbispora; 3 — культуры из рода Micropolyspora; 4 — формирование спорангиев у культур из рода Streptosporangium; 5 — зрелые спорангии и выход из них спор у Streptosporangium.Типичным признаком представителей рода чайниа (Chainia) является способность образовывать особые плодовые тела — склероции, внутри которых спор нет. Размножаются эти организмы спорами, которые формируются на спиральных или неспиральных спороносцах. Организмы из рода проактиномицес (Ргоactinomyces) размножаются оидиоспорами, которые формируются путем сегментации на коротких спороносцах. Мицелий этих организмов часто распадается на палочковидные и кокковидные формы. По характеру строения и развития мицелия род проактиномицетов разделяется на 2 типа —актиноидный и проак-тиномицетный. У актиноидного типа культур образуется воздушный мицелий, ветки которого имеют спороносцы. Мицелий расчленяется на нити и палочки. У культур проактиномицетного типа мицелий существует короткое время, он быстро расчленяется на короткие палочки и кокковидные клетки.
 Рис. 90—91. Гифы и спорангии у культур из рода Actinosporangium.
Рис. 90—91. Гифы и спорангии у культур из рода Actinosporangium.Все семейство микромоноспоровых (Micromonosporaceae) характеризуется общим признаком — способностью формировать споры на коротких спороносцах: по одной споре - род микромоноспора (Micromonospora); по две — род микробиспора (Microbispora); по нескольку спор — род микрополиспора (Micropolyspora, рис. 89, 1, 2, 3). Род актинобифида (Actinobifida) характеризуется дихотомическим ветвлением спороносных веток. На конце спороносца формируется одна спора. Организмы рода промикромоноспора (Promicromonospo-га) характеризуются тем же строением и развитием, что и микроорганизмы рода Proactino-myces, входящего в семейство Actinomycetaceae, прежде всего распадающимся мицелием, но плодоношение у этих организмов другое, как у семейства микромоноспоровых, — на коротких ветках мицелия формируются одиночные споры — конидии. Представителям семейства стрептоспорангиевых (Streptosporangiaceae) свойственно образование плодовых тел — спорангиев, в которых формируются споры. Способы образования спорангиев различны. У рода стрептоспорангиум (Streptosporangium) (рис. 89, 4,5) формирование спорангиев происходит путем спирального закручивания спороносящих веток, образуются шаровидные клубочки, покрытые общей оболочкой. Внутри этих клубочков нити расчленяются на короткие клетки — споры. При прорастании спор образуются 1—3 выроста, которые удлиняются, образуя мицелий. У представителей рода актиноспорангиум (Actinosporangium) споры формируются в скоплениях слизистой бесформенной массы типа спорангиев, но без оболочки. На рисунках 90 — 91 показаны последовательные этапы образования слизистых спорангиев у культур этого рода. При обильном образовании спорангиев колонии приобретают черную окраску.
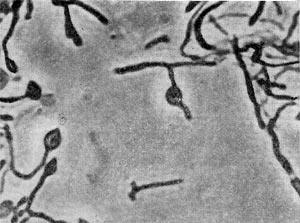 Рис. 92. Внутригифное (интеркалярное) образование спор у культуры из рода Intrasporangium.
Рис. 92. Внутригифное (интеркалярное) образование спор у культуры из рода Intrasporangium.В отличие от других форм у представителей рода микроспорангиум (Microsporangium) споры формируются в спорангиях на особых ветках — спорофорах, которые расположены пучками, прикрепленными к основанию спорангия (подобно кисточке). У организмов рода интраспорангиум (Intrasporangium) споры формируются также в спорангиях. В отличие от других организмов, образование спорангиев происходит интерка-лярно (внутригифно). В разных участках нитей мицелия образуется вздутие округлой или лимоновидной формы (от 5 до 20 мкм в диаметре). Спорангии заполнены кокковидными спорами (рис. 92).
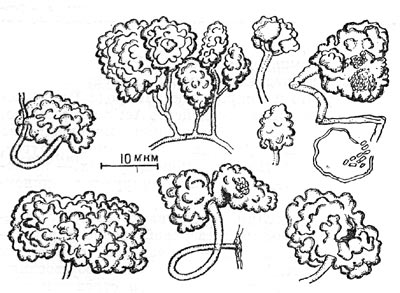 Рис. 93. Разнообразные формы спорангиев у Аmоrphosporangium.
Рис. 93. Разнообразные формы спорангиев у Аmоrphosporangium.У представителей рода элитроспорангиум (Elytrosporangium) споры формируются внутри бобовидных спорангиев в виде цепочек, которые образуются последовательно одна за другой. У организмов рода аморфоспорангиум (Аmоrphosporangium) спорангии, в которых находятся споры, имеют разнообразную неправильную форму (рис.. 93). Все вышеописанные организмы относятся к первому порядку лучистых грибков — Actinomycetales.
Семейства актинопланы (ACTINOPLANACEAE), дерматофилы (DERMATOPHILACEAE) и планоспоровые(PLANOSPORACEAE)
Эти семейства относятся ко второму порядку — Actinoplanales и объединяют организмы, которые в процессе развития образуют особые органы плодоношения и подвижные споры.
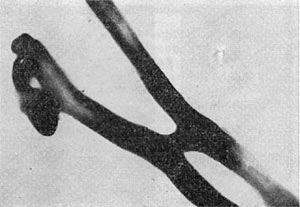
Рис. 94. Анастомоз у актиномицетов. Увел. X 20 000.
Подвижными могут быть также фрагменты нитей вегетативного мицелия. Споры формируются в плодовых телах — спорангиях. Фрагменты образуются путем дробления нитей мицелия без формирования плодовых тел. Споры и клетки фрагментов снабжены жгутиками, число которых у разных представителей варьирует.
Семейство актиноплан состоит из 5 родов. Организмы, входящие в это семейство, имеют хорошо развитый субстратный и воздушный мицелий, не отличающийся от мицелия актиномицетов, но образующий подвижные споры, которые формируются в спорангиях. Спорангии имеют оболочку, форма их может быть различной: грушевидной у представителей рода ампуллариелла (Аmрullаriеllа),бочковидной у организмов рода пилимелиа (Pilimelia). У организмов рода китазатоа (Kitasatoa) споры формируются путем отчленения споро-носца; образуются короткие цепочки, которые покрыты уплотненной слизистой капсулой, похожей на спорангии. Настоящие спорангии не выявлены.
На таблице 39 показано общее строение представителей рода актинопланес (Actinoplanes) и споры со жгутиками, подвижная клетка организма из рода дерматофилюс (Dermato-philus), фрагмент мицелия со жгутиками представителей рода проактинопланес (Proactino-planes). Представители семейства дерматофилы (Dermatophilaceae) в процессе развития не образуют спорангиев. Культуры имеют хорошо развитый мицелий, который расчленяется на палочки и кокки. Клетки снабжены жгутиками (род проактинопланес — Proactinoplanes). У представителей рода дерматофилюс (Dermatophilus) нити мицелия в отдельных частях подвергаются дроблению в разных направлениях, образуются веретеновидные раздутые участки мицелия. Формирующиеся в результате дробления нитей клетки снабжены жгутиками.
Организмы, объединяемые в семейство пла-носпоровых (Planosporaceae), имеют споры на .коротких ножках мицелия. Споры палочковидные, со жгутиками, формируются открыто, окружены слизистой капсулой, одиночные, парные или сгруппированы в короткие цепочки. В это семейство входит 4 рода: планомоноспора (Planomonospora), планобиспора (Planobispora), спорихтиа (Sporichthya) и дактилоспорангиум (Dactylosporangium), отличающиеся между собой количеством образующихся на гифах спор.
Для актиномицетов описано соединение нитей мицелия при помощи так называемых анастомозов. Ветка одной нити своим дистальным концом прикасается к оболочке другой нити, оболочки их растворяются, образуется канал, соединяющий две нити (рис. 94). Этот процесс — соединение гиф — можно рассматривать как автогамию — слияние ядерных элементов и цитоплазмы (примитивная форма полового процесса). У некоторых организмов можно наблюдать при прорастании спор образование проростков — коротких трубочек, которые соединяются с трубочками другой споры. На месте их соединения образуется новый росток.
Были описаны процессы рекомбинации у актиномицетов, при которых клетки двух разных культур с определенными признаками соприкасаются оболочками. В результате из клетки в клетку передаются определенные генетические признаки. Выросшие из таких смешанных культур колонии нового организма обладают свойствами двух находившихся в контакте исходных культур.
Культуральные свойства лучистых грибков
Представители разных групп лучистых грибков обычно хорошо растут на синтетических питательных средах, как на плотных агаризо-ванных, так и на жидких. Развитие микроорганизмов зависит от состава и реакции питательной среды, температурного и воздушного режимов, света, количества и качества посевного материала и других факторов. Из культу-ральных показателей для разделения актиномицетов на группы наиболее значима окраска культур — пигментация. По этому признаку лучистые грибки делятся на две группы -бесцветные и пигментированные. Первые при росте на питательных средах не образуют никаких красящих веществ. Воздушный мицелий таких актиномицетов может быть белым, светло-серым, кремовым, нижняя сторона колонии бесцветная. Актиномицеты второй группы образуют красящие вещества — пигменты. Колонии их при росте на питательных средах приобретают различную окраску: синюю, фиолетовую, красную, розовую, желтую, оранжевую, зеленую, черную, коричневую. Часто колонии окрашены в смешанные тона (табл. 40).
Пигменты образуются при свободном доступе кислорода. В анаэробных условиях многие культуры становятся бесцветными, пигмент исчезает. Пигменты актиномицетов обладают разнообразными химическими и физическими свойствами. Одни из них хорошо растворяются в воде и этиловом спирте; другие не растворяются в воде, но растворяются в спирте, эфире и других органических растворителях; третьи не растворяются ни в воде, ни в органических растворителях.
Нерастворимые пигменты тесно связаны с плазмой, не выделяются из клетки и, следовательно, не проникают в питательную среду. Пигменты, растворимые в воде, легко выделяются наружу и проникают в среду, окрашивая ее в соответствующий цвет.
Многие актиномицеты имеют внешне одинаковую синюю окраску, но оказалось, что красящие вещества их неоднородны как по химическому составу, так и по биологическим свойствам. Установлено, что в основном красящие вещества синих актиномицетов относятся к хинонам. Синие пигменты чувствительны к реакции среды и могут менять свою окраску под действием кислот и щелочей, приобретая соответственно красный или синий цвет. При помощи препаративной хроматографии на бумаге ученым удалось установить, что синие пигменты состоят из 3 или 5 компонентов. Среди лучистых грибков есть культуры синего цвета, но их пигменты иной природы. Такие пигменты в кислых растворах приобретают желто-красную окраску, а в щелочных — зелено-синюю.
Красящие вещества, образуемые фиолетовыми актиномицетами, очень сложны и состоят из большого числа компонентов (до 15). Первый антибиотик мицетин был получен из культуры актиномицетов фиолетовой окраски.
При изучении красно-оранжевых актиномицетов установлено, что пигменты их близки к липоактинохромам грибов. Такие пигменты не растворяются в воде. Оранжевые проактиномицеты способны образовывать каротиноидные пигменты, подобные пигментам моркови.
Среди лучистых грибков, образующих желтые пигменты, найдены такие, которые продуцируют значительное количество рибофлавина — витамина, содержащегося в молоке. У культур, окрашенных в зеленый цвет, зеленые пигменты отличаются физико-химическими свойствами. В основном это железосодержащие соединения. У одного из этих пигментов установлен элементарный состав. Интересно, что в нем содержится до 9% железа. Пигмент назван ферровердином.
Около 50% культур актиномицетов способны образовывать бурое вещество. Побурение культур наблюдается и среди актиномицетов, пигментированных в иные цвета. Установлено, что бурый цвет обусловлен наличием пигмента меланоидного типа, а также способностью актиномицетов продуцировать ферменты тирозиназу и лакказу. По данным некоторых ученых, ферментные системы типа лакказы участвуют в образовании гумуса и гумусоподобных веществ. Бурые соединения различных актиномицетов отличаются физико-химическими и биологическими свойствами. Используя данные о характере и условиях образования бурого вещества, исследователи разделили актиномицеты на группы, каждая из которых характеризуется своими, отличными от других групп организмов свойствами.
Физиологические и биохимические свойства лучистых грибков
Лучистые грибки очень неразборчивы в выборе пищи. Они могут развиваться на скалах, где имеются только ничтожные количества питательных веществ, в грунтах, содержащих углеводороды, и в почвах, разлагая при этом гумусовые вещества, труднодоступные для других микроорганизмов. Актиномицеты успешно конкурируют с другими микроорганизмами почвы, способны легко изменяться под влиянием окружающих условий и приспособляться к среде. Благодаря таким свойствам они широко распространены в природе, могут легко выращиваться в лабораторных условиях. Лучистые грибки культивируют на жидких и твердых питательных средах растительного и животного происхождения. Наиболее распространенными питательными средами для выращивания актиномицетов являются мясо-пептонный агар (МПА), картофельный агар (КА) и синтетический агар (СА), состоящий из набора солей (NaCl, KN03, K2HP04, MgSO4. Всеядность актиномицетов указывает на наличие у этих организмов систем, обеспечивающих возможность существования в различных субстратах.
Представители лучистых грибков используют в качестве источников азотного питания различные соединения минерального азота в виде нитратов, аммонийных солей. Способность усваивать тот или иной источник минерального азота у разных представителей лучистых грибков различна. Одна группа культур предпочитает усваивать нитраты; другая — аммонийные соли (NH4N03, NH4C1). Лучистые грибки используют азот и из органических соединений (мочевина, пептон, различные аминокислоты). Степень .усваивания аминокислот у разных культур различна. Так, аспарагиновая и глутаминовая кислоты и пролин ассимилируются почти всеми организмами, хуже усваиваются гистидин, лейцин, серии. Некоторые аминокислоты (аргинин, тирозин, аланин) стимулируют у пигментированных культур способность окрашиваться более интенсивно. Почти все представители лучистых грибков могут расщеплять различные белки (казеин, желатин, кератин).
Описаны, кроме того, автотрофные актиномицеты, которые хорошо развиваются на минеральных средах в присутствии углекислого газа как единственного источника углеродного питания. Большинство лучистых грибков гете-ротрофы. Они усваивают углерод из клетчатки, органических кислот, полисахаридов, спиртов, крахмала, глицерина и др. У лучистых грибков отмечается большое разнообразие в усвоении различных источников углеродного питания. Сахароза, глюкоза, манноза, левулеза усваиваются почти всеми актиномицетами.
Свойство организмов по-разному относиться к источникам углеродного питания используется в диагностических целях для разделения изучаемых организмов на соответствующие группы. Многие представители лучистых грибков хорошо усваивают углеводороды (керосин, парафин, бензин). В литературе описаны культуры актиноми-цетов и проактиномицетов, которые способны потреблять углерод из других органических соединений, трудно поддающихся разложению (каучук, поливиниловые пленки, битумы, асфальты).
В развитии лучистых грибков большую роль играют микроэлементы. Так, недостаток марганца вызывает у проактиномицетов формирование раздутых нитей. Для активного развития проактиномицетов, кроме марганца, необходим цинк. Присутствие в среде марганца стимулирует продуцирование определенными культурами актиномицетов антибиотика стрептомицина. Необходимыми элементами для роста и развития отдельных актиномицетов являются калий, магний, цинк, железо. Для продуцирования культурами витамина В12 необходим кобальт.
Присутствие больших доз микроэлементов может оказывать угнетающее действие на рост и развитие культур.
Естественные радиоактивные вещества стимулируют быстрый рост и развитие микробов. У пигментных культур актиномицетов под их действием ускоряются образование пигмента, процесс образования аминокислот, накапливается большое количество биомассы.
Способность лучистых грибков поселяться, расти, размножаться на многих субстратах, использовать для своего развития самые различные источники питания объясняется тем, что в клетках этих организмов есть набор разнообразных ферментов, благодаря которым культуры могут разрушать и образовывать сложные органические вещества. Набор ферментов в клетке обеспечивает также все необходимые жизненные процессы, происходящие в ней, включая и ее воспроизведение. Представители лучистых грибков образуют протеолитические ферменты — протеазы, с помощью которых культуры разлагают белки животного и растительного происхождения.
Белки разлагаются актиномицетами или до конечных продуктов (сероводорода, аммиака и воды), или до образования промежуточных веществ (пептонов, аминокислот). Интенсивность разложения белков зависит от условий аэрации, состава питательной среды, температуры и других факторов.
Среди лучистых грибков есть организмы (особенно среди рода Actinomyces), способные разрушать кератин (основной компонент роговых частиц, волос) при помощи фермента кератиназы.
Имеются культуры, у которых обнаружен фермент хитиназа, разлагающий хитин (ороговевшие части насекомых, животных). У многих представителей лучистых грибков выявлен фермент амилаза, при помощи которого организмы расщепляют крахмал с различной интенсивностью, в зависимости от вида культуры. Одни культуры разлагают крахмал до декстринов, другие — до Сахаров. У некоторых актиномицетов обнаружен фермент инвертаза, который расщепляет сахарозу на легкоусвояемые сахара — глюкозу и фруктозу. Отмечено, что проактиномицеты могут усваивать сахарозу без ее разложения.
Актиномицеты способны расщеплять при помощи фермента липазы жиры и жироподобные вещества.
Многие актиномицеты могут активно преобразовывать (трансформировать) некоторые соединения в биологически активные вещества - гормоны (кортизон, преднизон, преднизолон и др.). Найдены актиномицеты, которые способны трансформировать особые, полициклические соединения — стероиды — с образованием стероидных гормонов, являющихся регуляторами ферментативных процессов в организмах. Лучистые грибки содержат и окислительно-восстановительные ферменты. Один из таких ферментов — лакказа, при помощи которого разлагаются фенольные соединения гидрохинон, катехол и др.
Большинство лучистых грибков развивается при свободном притоке кислорода. Однако отдельные культуры могут расти и при некотором ограничении доступа кислорода. Строгие анаэробы среди лучистых грибков встречаются редко.
Среди проактиномицетов анаэробы встречаются чаще, чем среди актиномицетов, они обнаруживаются в организме животных и человека. Большинство лучистых грибков растет и развивается при температуре в пределах 25—30 °С (мезофилы). Термофильные организмы с температурным оптимумом роста 45—60 °С встречаются редко и чаще всего обнаруживаются среди микромоноспор.
Термотолерантные, т. е. устойчивые к высоким температурам, актиномицеты выдерживают нагревание до 60—70°С в течение часа. Наблюдается повышенная устойчивость к нагреванию и у спор мезофильных актиномицетов. Для нормального роста лучистых грибков лучшей питательной средой является среда с нейтральной или слабо щелочной реакцией (рН 7—7,2).
Лучистые грибки хорошо переносят высушивание. Так, некоторые культуры актиномицетов после девятилетнего пребывания в сухом виде в лабораторных условиях не потеряли своей жизнеспособности.
Лучистые грибки могут развиваться и при низкой влажности субстрата. Показано, что оптимальной влажностью для актиномицетов является 60% (от полной влагоемкости). При 23—30-процентной влажности почвы актиномицеты преобладают над прочими микроорганизмами, а при 8 — 10-процентной остаются единственными растущими представителями почвенной микрофлоры.
Одна из характерных особенностей лучистых грибков — большая изменчивость. При наблюдении в микроскопе культур актиномицетов можно легко обнаружить разнообразие морфологии клеток. Одни клетки имеют однородную плазму, другие — зернистую, вакуолистую. Величина отдельных клеток может также сильно колебаться. Гифы мицелия в отдельных участках выглядят раздутыми и не окрашиваются основными красками. В других участках гифы могут покрываться почкообразными выростами. Можно сказать, что в культурах нет совершенно одинаковых двух-трех клеток. Такое явление называется полиморфизмом, или возрастной изменчивостью организма. И эта изменчивость не случайна, а биологически закономерна. Причем популяция клеток разнокачест-венна не только морфологически, но и биохимически. В одних клетках биохимические превращения протекают интенсивно, в других — медленно. Изменения в организме могут быть длительными и кратковременными.
Благодаря разнообразию своих клеток лучистые грибки имеют большую возможность приспособиться к различным условиям среды. Не будь этой разнокачественности клеток, вся культура погибла бы при первом же неблагоприятном воздействии на нее. Малейшие отклонения в составе питательной среды или условий культивирования вызывают изменения организма.
Культуральный полиморфизм у представителей лучистых грибков проявляется разнообразно. У одной и той же культуры может меняться внешний вид колонии, они могут быть гладкими, бугристыми, морщинистыми. В одних случаях колонии обильно покрыты воздушным мицелием, в других — он слабо развит или совсем отсутствует. Пигментированные культуры могут обесцвечиваться.
Отмечаются отклонения и в образовании спороносцев. Одна и та же культура может образовывать то спиральные, то неспиральные спороносцы, то длинные, то короткие нити. Клетки могут различаться между собой быстротой роста, размножения, формирования спор. Рост и развитие организма протекает в определенных пределах, свойственных каждому организму и обусловленных его наследственными признаками. Когда же изменяется среда, переставая быть привычной для организма, организм либо гибнет, либо приспосабливается к новым условиям, меняя свои свойства. Получается новый вариант организма.
Ученые наблюдали образование таких вариантов под влиянием изменившейся среды или под воздействием внешних факторов: лучистой энергии, рентгеновских и ультрафиолетовых лучей, химических агентов и др. В результате таких воздействий получаются наследственно закрепленные варианты.
Изменения затрагивают как внешние морфологические и культуральные признаки, так и биохимические.
В процессе длительного выращивания лучистых грибков на той или иной питательной среде микроорганизмы постепенно начинают потреблять соединения, которых они до этого не усваивали. Адаптация к питательному субстрату особенно ярко выражена у актиномицетов.
Такую физиологическую перестройку можно вызвать у организмов в отношении многих источников углеродного, азотного питания, а также дополнительных веществ — витаминов, аминокислот и др. Последовательно приучая микроорганизмы к тому или иному субстрату или индивидуальному веществу, можно получить так называемые зависимые мутанты. Эти мутанты уже не растут без веществ, к которым приспособились. Мутационные изменения могут быть морфологического, физиологического и биохимического характера.
Морфологические изменения у актиномицетов хорошо проявляются при образовании мутантов, которые потеряли способность формировать воздушный мицелий. Колонии таких культур голые, на поверхности спороносцы и споры не образуются. Весьма показательны мутации организмов с потерей физиологического признака — способности окрашиваться. Такие мутанты резко отличаются от исходной культуры по цвету. Часто можно встретить культуры, которые утратили способность образовывать такие вещества, как антибиотики, аминокислоты, витамины и др.
Биологически активные вещества, продуцируемые актиномицетами
Лучистые грибки обладают очень ценным свойством — способностью образовывать весьма разнообразные вещества, многие из которых имеют большое практическое значение. В естественных местах обитания между микроорганизмами складываются различные взаимоотношения.
В природе широко распространено явление симбиоза и антибиоза.
Подавление жизнедеятельности одних микроорганизмов другими связано с выделением различных продуктов жизнедеятельности, в том числе специфических химических веществ — антибиотиков, обладающих способностью убивать окружающих микробов или препятствовать их росту.
Подробнее об антибиотиках, в том числе и о продуцируемых актиномицетами, будет рассказано в других главах книги. Актиномицеты могут продуцировать также вещества, угнетающие рост и развитие растений и полезной микрофлоры. К этим веществам относятся фитотоксины. Некоторые из них резко подавляют рост растений (смоченные ими семена не прорастают). Другие токсины действуют слабее, они только задерживают прорастание семян и рост проростков.
Некоторые токсины вызывают внешне слабо выраженное угнетение роста растений, которое, однако, отражается на биохимических процессах, протекающих в тканях. В таких растениях нарушается химический состав. Актиномицеты-ингибиторы живут в различных почвах, особенно часто их обнаруживают в подзолистых и красноземах. При большом скоплении токсинов происходит отравление почвы (утомление). На таких почвах развитие растений угнетается, урожай снижается.
Но если в такую почву внести препараты, содержащие актиномицеты-антагонисты, специально подобранные к микробам, которые образуют токсические вещества, то под действием таких актиномицетов происходит устранение микробов-токсинообразователей и почва становится менее токсичной для растений. Оздоровляющее действие они оказывают также на организм человека и животных при инфекционных заболеваниях. Между микробами положительного и отрицательного действия возникают сложные взаимоотношения, в результате которых создаются определенные микробные ценозы — сообщества.
Живое население почвы следует рассматривать как важный фактор плодородия почвы, от которого зависит урожайность растений. Представители лучистых грибков играют в этом процессе одну из ведущих ролей.
Лучистые грибки обладают способностью образовывать биологически активные вещества, которые стимулируют рост и развитие высших и низших организмов. Из культур актиномицетов были выделены такие вещества, как биотин, тиамин, рибофлавин, пантотеновая и никотиновая кислоты, каротиноидные пигменты, аминокислоты, ауксины и другие ростовые вещества. Часть образованных актиномицетами веществ утилизируется самими продуцентами, а избыток выделяется в среду обитания. Обогащение субстрата биологически активными веществами происходит и за счет распадающихся микробных клеток. Продуцирование лучистыми грибками тех или иных веществ зависит от возраста культуры, вида микроорганизмов и условий культивирования. В почве происходят непрерывные процессы синтеза и разрушения биологически активных веществ. Их количество в почве определяется интенсивностью деятельности микробов и скоростью разрушения или длительностью сохранения.
Биовещества микробного происхождения положительно влияют на растения, усиливая в них биологические процессы, увеличивая содержание белков, аминокислот, витаминов и ряда других соединений, повышающих качество урожая.
Активные вещества актиномицетного происхождения применяются в животноводстве, а также для защиты растений от вредоносных насекомых.
Для борьбы с непарным шелкопрядом очень эффективным оказался виоларин, выделенный из культур фиолетовых актиномицетов (Act. violaceus). На таблице 41 показано действие антибиотика на гусениц непарного шелкопряда.
Почти все культуры актиномицетов способны продуцировать витамины группы В. Так, Act. olivaceus образует антианемический витамин В19. Витамин В12 практически не встречается в растениях. Его получают из печени крупного рогатого скота и из микробов — пропионовокислых бактерий и актиномицетов. Актиномицеты хорошо растут, развиваются и образуют витамин В12 на питательной среде, в состав которой входит молочная сыворотка, янтарнокислый аммоний и мочевина.
Бродильной, текстильной, кожевенной и другим отраслям промышленности требуются химически чистые препараты ферментов. Для удовлетворения потребности народного хозяйства в ферментах весьма перспективно использование актиномицетов. Так, кератиназу, применяемую в кожевенной промышленности для удаления шерсти со шкур, получают из культур Act. fradiae. На рисунке 95 показано действие кератиназы на коровий волос.
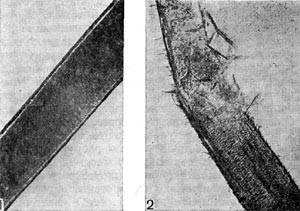 Рис. 95. Действие фермента кератиназы, полученной из актнномицета, на волос: I — волос, не обработанный ферментом; 2 — волос, обработанный ферментом кератиназой.
Рис. 95. Действие фермента кератиназы, полученной из актнномицета, на волос: I — волос, не обработанный ферментом; 2 — волос, обработанный ферментом кератиназой.При помощи некоторых культур актиномицетов были получены стероидные гормоны. В медицине гормоны широко применяются для лечения различных заболеваний. Стероидные гормоны до недавнего времени получали из желез внутренней секреции животных. Но для выработки, например, 1 кг кортизона нужно забить несколько тысяч голов крупного рогатого скота.
Некоторые растения, например паслен птичий, содержат химические вещества, из которых можно получить кортизон. Но выделить эти вещества из растений очень трудно, выход гормона низок.
Порядок микобактерии (MYCOBACTERIALES)
В этот порядок входят организмы с палочковидными грамположительными клетками. Для типичных форм свойственно хорошо выраженное ветвление. Ветвящиеся клетки на поздних стадиях развития культур превращаются в кокко-видные формы. В семейство Mycobacteriaceae входят следующие роды: микококки (Mycococcus), пропионово-кислые бактерии (Propionibacterium), микобактерии (Mycobacterium), лактобак-терии (Lactobacterium), псевдобактерии (Pseudobacterium) и близкие к ним артробактерии (Arthrobacter), целлюломонас (Cellulomonas), коринебактерии (Corynebacterium), бревибактерии (Brevibacterium) и другие микоформы.
Свойства микобактерии далее будут подробно рассмотрены на примере двух родов: Mycobacterium и Mycococcus.
Род микобактерии (MICOBACTERIUM)
Микобактерии давно служат объектом разносторонних исследований. После того как Р. Кох в 1882 г. открыл возбудителя туберкулезного заболевания, начались многочисленные поиски этих организмов в природе.
В связи с этим большое значение имеет получение стероидных гормонов путем трансформации стероидов с помощью микроорганизмов. Например, микробиологический метод получения кортизона состоит в том, что к углероду, находящемуся в 12-м положении, присоединяется атом кислорода. Ученые показали, что эту реакцию могут легко и быстро осуществлять актиномицеты.
Впервые превращение стероидов микроорганизмами наблюдал Т. А. Таусонв 1932 г. При помощи микроорганизмов были получены кор-тикостероиды: кортизон и гидрокортизон, а из них — преднизон и преднизолон.
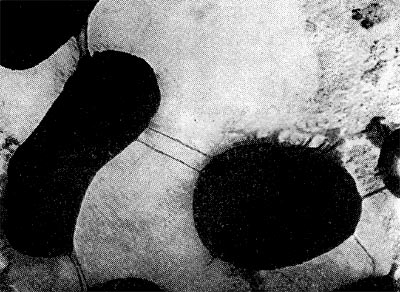
Рис. 96. Клетки Mycobacterium lacticolum. var. aliphaticum. Увел. Х 40 000.
Приведенным перечнем веществ, продуцируемых лучистыми грибками, не исчерпываются их возможности как продуцентов биологически активных веществ. Так, актиномицеты способны образовывать из простых углеводородов сложные органические вещества: белки, жиры, углеводы и другие соединения.
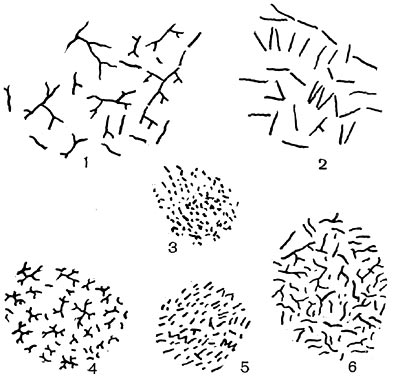
Рис. 97. Общая картина микроскопических препаратов микобактерий. Односуточные культуры на синтетической агаризованной среде. Увел. X 600. (По Н. А. Красильникову.) 1 — Mycobact. hyalinum; 2 — Mycobact. rubrum; 3 — Mycobact. cyaneum; 4 — Mycobact. bifidum; 5 — Mycobact. citreum; 6 — Mycobact. filiforme.
Нет сомнений, что среди лучистых грибков есть и такие, которые могут продуцировать и более важные вещества, чем упомянутые выше. Выявить такие микроорганизмы и заставить их работать на пользу человека — задача микробиологов.
Кох предполагал, что, кроме туберкулезной палочки, в природе существуют другие близкие к ней бактерии. Это предположение вскоре подтвердили многочисленные авторы, которые находили организмы, внешне похожие на туберкулезные, на разных субстратах: сливочном масле, молоке, траве, в почве, воде и т. д.
Морфология и физиологические свойства
Если нитчатое строение и ветвление клеток актиномицетов имеет у проактиномицетов нестойкий и непостоянный характер, то у микобактерии мы находим только некоторые элементы такого строения. У микобактерии мицелий вообще не образуется. На ранней стадии развития (в первые сутки) микобактерии имеют палочковидное строение клеток, и в этот момент они морфологически похожи на проактиномицетов, находящихся во второй стадии развития. Палочковидные клетки микобактерии, в отличие от бактериальных, имеют неправильные очертания: контуры их искривлены, в разных местах они неодинаковой толщины, часто кол-бовидно раздутые, клетки более или менее изогнуты, одиночные или соединены в пары или короткие цепочки (рис. 96). Цепочки никогда не бывают правильно очерченными и прямыми,. строго расположенными в одну линию, как это наблюдается в культурах бактерий; обычно они угловато искривленные. На рисунке 97 показан общий вид односуточных культур разных видов микобактерий, наиболее типичных по своему строению и расположению клеток.
Величина клеток микобактерий меняется в зависимости от вида культуры и состава среды. В молодом возрасте чаще всего клетки имеют длину 2,5— 7,0 мкм. Нередко встречаются организмы, величина которых не превышает 2—3 и даже 1—2 мкм, немало форм и с более длинными клетками, 10—15 мкм. Поперечник клеток у разных видов микобактерий также различен; чаще всего он равен 0,6—0,7 мкм. Однако нередко встречаются культуры с толщиной клеток 0,2—0,3 и 0,8—1,0 мкм. Толщина клеток микобактерий — величина более постоянная, чем длина.
В культурах микобактерий более старого возраста (2—3-суточных) клетки укорачиваются (рис. 98) и принимают кокковидную форму. Кокковидные клетки имеют такой же диаметр, как и палочки, или несколько больший; одиночные, или соединены в пары, или короткие кривые цепочки, или механически сцеплены в кучи. На этой стадии развития микобактерий легко можно принять за микрококки. Кокковидные клетки некоторое время продолжают размножаться, а затем переходят в состояние покоя. Таким образом, микобактерий в своем развитии проходят цикл превращений из палочковидных форм в кокковидные. Поэтому, чтобы с достоверностью установить принадлежность организма к микобактериям, надо вести последовательное наблюдение за его развитием.
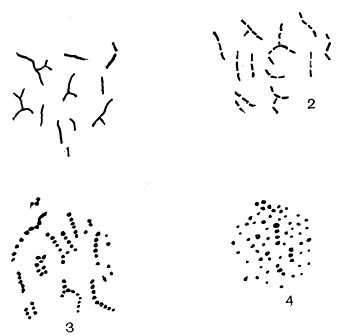
Рис. 98. Последовательное развитие клеток Mycobact. hyalinum на сусло-агаре. Увел. X 600. (По Н. А. Красильникову.) 1 — 1-суточная культура; 2 — 2-суточкая культура; 3 — 3-суточная культура; 4 — 10-суточная культура.
Другим характерным морфологическим признаком микобактерий является ветвление. Ветки образуются на боковой поверхности палочковидных клеток так же, как у проактиномицетов и актиномицетов. Степень ветвления у разных микобактерий неодинакова: у одних клетки при благоприятных условиях образуют многочисленные ветки, по 2—5 на каждой клетке, у других обычно по 1—2 ветки (рис. 97). У многих видов ветвящиеся клетки встречаются вообще редко, а на некоторых средах вообще не обнаруживаются. Наконец, имеется много культур, у которых ветвление обнаруживается только при особых условиях культивирования. Например, у синих (Мусоbacterium cyaneum) и черных (Mycobact. nigrum) микобактерий ветвления на обычных средах (МПА, сусло-агар) не наблюдается, клетки имеют бактериальное строение; при посеве их на ломтики картофеля или в жидкие среды обнаруживается большое количество типичных ветвящихся клеток. Следовательно, ветвление у микобактерий зависит в значительной степени от питательной среды.
В тех случаях, когда культура вызывает сомнение в принадлежности к микобактериям, приходится проверять ее на различных средах, чтобы обнаружить ветвление. Ветвление у микобактерий, как правило, наблюдается только в ранней стадии развития, в период наиболее бурного роста и размножения клеток. В старых культурах ветвящиеся формы не встречаются.
Все микобактерии неподвижны, окрашиваются по Граму положительно, кислотоупорны. При развитии в жидких средах эти микроорганизмы вызывают равномерное помутнение сред. Колонии микобактерии всегда тестообразной консистенции; поверхность их гладкая, реже бугристая или складчатая; у некоторых видов микобактерии колонии слизистые, растекаются по поверхности агара. Культуры микобактерии пигментированы — синие, красные, оранжевые, желтые, зеленые, черные; встречаются и бесцветные.
Развиваются микобактерии на различных субстратах. Они хорошо усваивают белки, углеводы, жиры, воск, парафин. Ферментативная деятельность у разных видов различна: как правило, красные микобактерии обладают слабой ферментативной активностью, лимонно-желтые или белые образуют очень активные ферменты. Среди микобактерии есть формы, хорошо развивающиеся на безазотистой среде, способные усваивать азот атмосферы.
Микобактерии не обладают антагонистическими свойствами и не образуют антибиотиков.
РазмножениеМикобактерии размножаются делением, перешнуровыванием и почкованием. Наиболее часто встречается деление (рис. 99). В клетках, достигших определенной величины, образуются поперечные перегородки, и клетки распадаются пополам, разламываясь как бы от сильного толчка. Перелом клеток происходит настолько быстро, что уловить этот момент бывает очень трудно, наблюдая за делением клеток в микроскоп. После перелома дочерние клетки располагаются под углом друг к другу или параллельно (рис. 99,7).
При размножении клетки перешнуровыванием (рис. 99,2) сначала появляется едва заметная перетяжка, которая постепенно углубляется, становится все более заметной, и клетка перетягивается пополам. Иногда'клетка перешнуровывается одновременно в нескольких местах.
Почкование у микобактерии встречается довольно часто. Почки образуются чаще на конце клетки или на боковой поверхности (рис. 99,5). Сначала появляется маленький бугорок, который увеличивается, округляется, затем отваливается или, оставаясь соединенным с материнской клеткой, развивается дальше. Почки, часто вытягиваясь в длину, превращаются в палочковидные ветки. Трудно в таких случаях установить, что считать почкой, а что -веткой, так как и почкование, и ветвление представляют, в сущности, один и тот же процесс. Различие заключается лишь в том, что при настоящем ветвлении ветки не отделяются и не могут существовать самостоятельно. Почкование у микобактерии чаще наблюдается при росте на сусло-агаре и ломтиках картофеля.
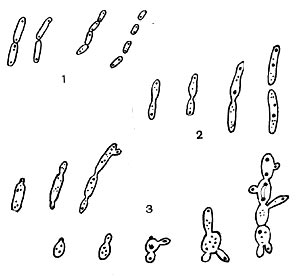
Рис. 99. Размножение микобактерпй. (По Н. А. Красильникову.) Увел. X 3000. 1 — деление клеток; 2 — перешнуровывание клеток; 3 — почкование.
Микобактерии могут образовывать споры. При этом плазма внутри клетки распадается на отдельные участки — фрагменты, которые слегка сжимаются и уплотняются (рис. 100). Эти фрагменты представляют собой самостоятельные зародышевые тельца — споры. На образование спор затрачивается все содержимое клеток. По мере формирования спор оболочка клетки постепенно ослизняется, становится менее заметной, наконец, исчезает, и споры освобождаются. По способу образования и биологическому значению споры микобактерий резко отличаются от эндогенных спор бактерий. Эндогенные споры хорошо переносят неблагоприятные условия, способствуя сохранению вида. Как правило, в клетке формируется одна спора, редко две, причем по внешним признакам такие клетки резко отличаются от вегетативных. В клетке микобактерий всегда образуется несколько спор, которые неустойчивы к внешним воздействиям; по внешним признакам они мало отличаются от вегетативных форм; спорообразование является одним из способов размножения.
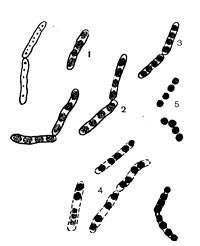
Рис. 100. Спорообразование у Mycobact. hyalinum. (По Н. А. Красилышкову.) Увел. X 3000: 1 — концентрация плазмы на отдельные участки-фрагменты; г, s — уплотнение фрагментов и превращение их в споры; 4 — растворение оболочки клеток; 5 — зрелые споры.
Парафинокисляющие микобактерии
Одной из наиболее интересных особенностей микобактерий является их способность разлагать такие химически инертные соединения, как углеводороды, содержащиеся в нефти.
Предельные углеводороды вследствие строения молекул не вступают в реакции присоединения, а в реакции замещения вступают лишь при высоких температурах и давлении. Такие углеводороды и названы парафинами, что означает «обладающий малым сродством».
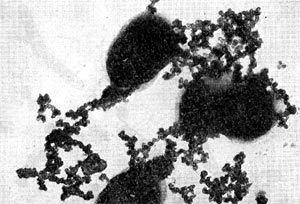
Рис. 101. Культура Mycobact. ceroformans на среде с гексадеканом. Увел. X 20 000.
В последнее время ученые многих стран мира занимаются изучением углеводородокисляющих микроорганизмов. Такой повышенный интерес к ним связан с тем, что с помощью подобных микроорганизмов открываются возможности получения технического белка и других ценных продуктов из непищевого сырья, а также борьбы с нефтяными загрязнениями биосферы.
Лучистые грибки составляют основную массу микроорганизмов, способных усваивать углеводороды. Впервые углеводородокисляющие лучистые грибки были описаны голландским микробиологом Зенгеном, который обнаружил их в садовой почве, воде каналов и навозе. Для выделения этих микроорганизмов в чистую культуру Зенген применил простой, но эффективный метод. Он приготовил в колбах раствор минеральных солей, необходимых для развития микробных клеток. К этому раствору Зенген добавил парафин. В колбы со средой ученый внес комочки почвы. Поскольку парафин являлся единственным органическим веществом в среде, то в колбах развивались только те микроорганизмы, которые могли его усваивать. Таким методом Зенген в 1913 г. выделил 6 видов микобактерий, которые хорошо развивались на нефти или ее очищенных фракциях — бензине, парафиновом масле, твердом парафине.
Исследования Зенгена помогли понять, каким образом из каналов и рек постепенно исчезает нефть, оставленная судами. Ее разлагают микроорганизмы. Позднее парафинокисляющие лучистые грибки были найдены и другими исследователями в различных почвах, воде и иле водохранилищ; при этом чаще всего встречались микобактерии. Особенно богаты парафин-окисляющими микобактериями почвы и пластовые воды нефтеносных районов, а также почвы на территории гаражей, нефтеперерабатывающих заводов, стоянок сельскохозяйственных машин и т. д.
Парафинокисляющие микобактерии характеризуются способностью легко разлагать углеводороды. Это свойство, как оказалось, присуще обширной группе микобактерий. Поэтому большая часть парафинокисляющих микобактерий была отнесена выделившими их исследователями к известным видам. Если суммировать эти данные, то мы увидим, что видовой состав парафинокисляющих микобактерий не слишком разнообразен и составляет примерно 20 видов. Наиболее часто встречаются Мусоbact. lacticolum, Mycobact. flavum, Mycobact. luteum, Mycobact. luteum, Mycobact. mucosum. Поскольку большая часть парафинокисля-ющих микобактерий принадлежит к известным видам, то строение их клеток типично для этих видов. Отличием является несколько меньший размер клеток культур, растущих на среде с парафином. Например, клетки Mycobact. lacticolum var. aliphaticum при росте на мясопептонном агаре имеют длину 3—4 мкм и толщину 0,8—1 мкм, на среде с парафином клетки этой 'же культуры мельче (длина 2—3 мкм и ширина 0,4—0,6 мкм).
Кроме известных видов, ученые обнаружили и такие культуры, которые по своим свойствам не совпадали ни с одним из описанных. Например, был выделен новый вид — Mycobact. viridae. Эти микроорганизмы отличались от остальных тем, что росли только на среде с парафином и не развивались на обычно употребляемых питательных средах; кроме того, они образовывали ярко-зеленый пигмент. Описано два новых вида парафинокисляющих микобактерий — Mycobact. ceroformans и Mycobact. раraffmicum. Исследование клеток этих организмов с помощью электронного микроскопа показало, что они обладают интересными морфологическими особенностями, не найденными до сих пор у микобактерий других видов. Оказалось, что клетки Mycobact. ceroformans окружены гроздевидными образованиями, которые прикреплены к оболочке клетки и состоят из отдельных округлых гранул (рис. 101). Сама оболочка имеет неровную, бугристую поверхность, усеянную тонкими нитями. Из крупных бугров на поверхности клетки, очевидно, и происходит выделение гранулярного вещества (рис. 102). Причем подобные гроздевидные структуры отсутствуют, если клетки Mycobact. ceroformans выращены на среде без углеводородов.
Рис. 102. Клетка Mycobact. ceroformans на среде с гексадеканом. Увел. X 30 000.
Клетки Mycobact. paraffinicum обладают длинными нитевидными выростами, при помощи которых они соединяются между собой и образуют гроздевидные или розетковидные скопления (рис. 103). Эти выросты отходят, как правило, от боковых сторон палочковидных клеток. В обычном микроскопе они видны уже в молодой (8-часовой) культуре, в суточной культуре выростов становится больше. При помощи этих выростов клетки соединяются друг с другом, образуя крупные скопления, состоящие из многих десятков, а иногда и сотен клеток (рис. 104). В электронном микроскопе видно, что выросты от разных клеток, встречаясь, спирально закручиваются один вокруг другого, образуя узловатые стволы — утолщения (рис. 105). К этим утолщениям присоединяются все новые выросты от других клеток. В конце концов, образуются очень крупные корневидные структуры, толщина которых может превышать диаметр вегетативных клеток (рис. 106). Подобные структуры клетки Mycobact. paraffinicum образуют не только на среде с парафином, но и на других средах. Однако меньше всего их наблюдается при выращивании культуры на самой богатой питательными веществами среде — мясопептонном агаре.
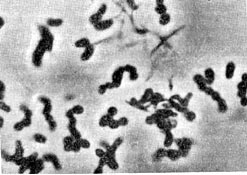
Рис. 103. Культура Mycobact. paraffinicum. Соединение клеток при помощи выростов. Увел. X 2400.
Роль этих структур в жизни клеток еще не выяснена. Возможно, при их помощи происходит обмен продуктами метаболизма отдельных клеток или осуществляется максимальный контакт с субстратом. Последнее обстоятельство для парафинокисляющей культуры чрезвычайно важно. Действительно, ведь углеводороды нерастворимы в воде. Несмотря на это, углево-дородокисляющие микобактерии прекрасно развиваются в водной среде с парафином. Как же осуществляется контакт между ними и субстратом? Оказалось, что клетки микобактерии прочно прикрепляются к каплям парафина, окружая их плотным слоем (рис. 107), и в этом процессе, по-видимому, определенную роль играют поверхностные клеточные структуры. Постепенно парафин из капли «выедается», а слой клеток нарастает.
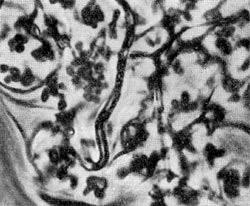
Рис. 104. Скопление клеток Mycobact. paraffinicum, соединенных выростами. Увел. X 2400.
Большинство парафинокисляющих микобактерии, кроме углеводородов, может использовать и другие субстраты — сахара, органические кислоты, высшие спирты, жиры и пр. Но среда с углеводородом является для микобактерии оптимальной. Очень немного таких культур, которые нормально растут и развиваются только на среде с углеводородом (или продуктами его окисления), а при переносе на среды с другими субстратами погибают. Такова, например, Mycobact. ceroformans. Химическое строение углеводородов очень разнообразно. Различают ациклические, алициклические и ароматические углеводороды. Ациклические углеводороды представляют собой соединения с открытой цепью углеродных атомов, не содержащие в молекулах колец, или циклов. Они могут быть предельными, или насыщенными (парафины), и непредельными (ненасыщенными), с двойными или тройными связями между атомами углерода. К алициклическим соединениям относят все вещества, содержащие кольца из углеродных атомов, кроме бензола и его производных. Наконец, к ароматическим углеводородам относятся вещества, имеющие в молекуле особую кольцевую группировку — бензольное ядро. И отношение углеводородокис-ляющих микобактерии к этим соединениям неодинаково.
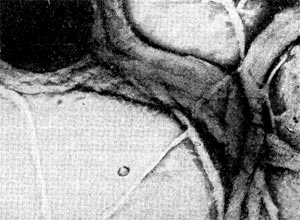
Рис. 105. Отростки от разных клеток Mycobact. paraffinicum при встрече закручиваются вокруг друг друга. Увел. X 42 000.
Ациклические углеводороды окисляются микобактериями гораздо легче ароматических. Однако разные группы ациклических углеводородов окисляются лучистыми грибками также с разной интенсивностью. Газообразные углеводороды — метан, этан, пропан и бутан — используются многими микобактериями, но с отчетливо выраженной приспособленностью микроорганизма к одному определенному соединению. Так, известно несколько видов мико-бактерий, окисляющих только метан. Очень немногие лучистые грибки могут усваивать жидкие летучие углеводороды (от пентана до октана). Углеводороды с числом углеродных атомов от 12 до 18 наиболее доступны. Однако и к ним разные штаммы относятся неодинаково. Например, Mycobact. paraffinicum предпочитает углеводороды с цепочкой из 16 —18 атомов углерода, a Mycobact. lacticolum var. aliphaticum — с цепочкой из 13—18 атомов. Все углеводороды с прямой цепью усваиваются микобактериями легче, чем с разветвленной; ненасыщенные легче насыщенных. Даже такие вещества, как асфальт, битумы, резина, каучук, разрушаются лучистыми грибками.
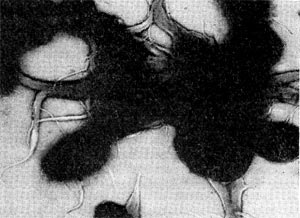
Рис. 106. Культура Mycobact. paraffinicum. Образование крупных корневидных структур. Увел. X 20 000.
Mycobact. citreochromogenum, найденная в образцах подземных вод нефтеносных районов, окисляет различные ароматические углеводороды, но особенно хорошо нафталин. Этот микроорганизм разлагает также и парафины.
Механизм разложения углеводородов. Окисление углеводородов микобактериями представляет собой ряд ферментативных реакций, следующих одна за другой, конечным продуктом которых является жирная кислота — наиболее окисленное соединение:
СН3-(СН2)п-СН2-СН3->- СН3—(СН2)„—СН2—СН2ОН ->СН3-(СН2)-СН2-СНО -> СН3—(СНа)—СН2-СООН. спирт углеводород альдегид кислота
Самым важным в этой цепи является первый этап — введение кислорода в молекулу углеводорода. Первичное окисление парафинов микобактериями может идти двумя путями:
1) в окисляемую молекулу вводятся два атома кислорода, образуется гидроперекись, которая затем превращается в спирт:
СН3-(СН2)n-СН3 -> СН3-(СН2)n - СН2-0-ОН H2-> СН3-(СН2)n - СН2ОН+Н20;
2) в окисляемую молекулу вводится один атом кислорода, спирт образуется сразу:
O2, H2 СН3-(СН2)П-СН3 - -> СН3-(СН2)n-СН2ОН+Н20.
Интенсивность окисления углеводорода зависит от того, насколько насыщена среда кислородом, т. е. от аэрации. Спирты и альдегиды являются промежуточными продуктами окисления углеводородов, в клетках они не накапливаются. Конечный продукт окисления — кислоты. С помощью метода газожидкостной хроматографии было выявлено, что при окислении высокомолекулярных парафинов в клетках мико-бактерий обычно накапливаются жирные кислоты с таким же числом углеродных атомов, какое имел исходный углеводород. В меньшем количестве присутствуют кислоты, углеродные цепи которых укорочены на два углеродных фрагмента. Так, в клетках Mycobact. paraffinicum, окисляющей углеводород гексадекан С16Н34, содержатся следующие жирные кислоты: пальмитиновая С16Н3202 (74%), маргариновая С14Н28О2 (18%), лауриновая С12Н2402 (6%) и каприновая С10Н2002 (2%).
Жирные кислоты в свободном состоянии содержатся в клетках в небольшом количестве. Часть их используется микобактериями на синтез клеточных жиров и жироподобных веществ — липидов. Другая часть жирных кислот расщепляется на низкомолекулярные вещества, использующиеся клеткой для построения белков, углеводов и других необходимых соединений.
Липиды парафинокисляющих микобактерий, как, впрочем, и других микроорганизмов, представляют собой производные жирных кислот — триглицериды, воск и ряд специфических соединений. Все это — вещества сложно-эфирной природы. Так, триглицериды, выделенные из клеток Mycobact. paraffinicum, окисляющей гексадекан, представляют собой эфиры глицерина и трех жирных кислот — пальмитиновой, маргариновой и лауриновой. Причем преобладает в этой смеси соединение, называемое трипальмитином.
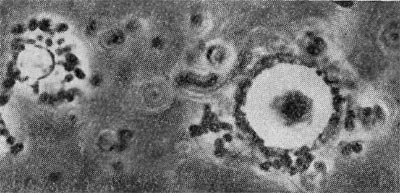
Рис. 107. Клетки Mycobact. ceroformans на каплях парафина. Увел. X 2300.
Трипальмитин входит в состав многих природных жиров, в частности сливочного масла.
Воска — это тоже сложные эфиры, образованные высшими жирными кислотами и высшими спиртами. Некоторые виды парафинокисляющих микобактерий накапливают в клетках большое количество воска. Например, в культуре Mycobact. ceroformans при выращивании на среде с гексадеканом накапливается в больших количествах воск цетилпальмитат, который образуется из цетилового спирта и пальмитиновой кислоты. Исследование липидов парафинокисляющих микобактерий помогает раскрыть механизм окисления углеводородов разными штаммами микобактерий.
Распространение в природе
Микобактерий широко распространены в природе. Среди них есть как патогенные виды, вызывающие тяжелые заболевания у человека и животных, так и безвредные организмы, часто встречающиеся в почве, воде, пищевых продуктах.
Толчком к изучению микобактерий послужила их патогенность. Первым был открыт возбудитель туберкулеза — Mycobact. tuberculosis, о котором упоминалось в начале главы. Попадая в организм животного или человека, туберкулезная микобактерия поселяется на ткани и начинает размножаться. Образуется небольшой бугорок сероватого цвета, в центре которого находится скопление клеток микобактерий. Постепенно отдельные бугорки сливаются, омертвевшая ткань превращается в крошковатую желтую массу, образуется так называемый творожистый некроз. В случае поражения легких эта творожистая масса выделяется при кашле, а на месте некроза остается большая полость (каверна).
С глубокой древности известна людям болезнь проказа. В 1874 г. норвежским врачом Гансеном был открыт возбудитель проказы — Mycobact. leprae. К микобактериям относится и возбудитель дифтерии — Mycobact. diphtheriae (синоним — Corynebacterium diphtheriae). Поселяясь на слизистой зева или носа, эти организмы начинают выделять токсическое вещество. Дифтерийный токсин — один из самых сильных биологических ядов. Проникая в кровь, он поражает сердце, почки, надпочечники и нервы; иногда возможен летальный исход. Токсин нейтрализуется антитоксином, который есть в организме больного (естественный иммунитет) либо вводится в виде сыворотки. Недавно установлено химическое строение дифтерийного токсина. Он представляет собой сложный эфир миколовой кислоты и дисахарида трегалозы. Помимо описанных возбудителей туберкулеза, проказы, дифтерии, есть и другие виды микобактерий, патогенные для человека и животных. Фитопатогенные формы встречаются редко.
Наряду с описанными существует очень много микобактерий совершенно безвредных. Это — сапрофитные формы. Большая часть их обитает в почве, где принимает активное участие в минерализации органических остатков. Они могут разлагать такие вещества, которые недоступны другим микроорганизмам или плохо усваиваются, например нефтяные остатки, воск, гуминовые соединения и др. Микобактерий прекрасно развиваются в почве с минимальной влажностью, при температуре, которая задерживает рост других организмов, а также в почвах с большим содержанием солей. Благодаря этим особенностям микобактерий играют особенно важную роль в превращении органических веществ в засушливых жарких районах, а также засоленных почвах.
Микобактерий принимают участие в процессах силосования, квашения, в приготовлении некоторых молочнокислых продуктов и сыров.
Применение
Микроорганизмы, «поедая» углеводороды, содержащиеся в нефти, накапливают значительное количество клеточной массы. Более половины этой массы составляет белок. Таким образом, выращивая парафинокисляющие микроорганизмы на нефтяных фракциях, можно получать белок из непищевого сырья. Для получения белка из углеводородов используют дрожжевые организмы, так как белок парафинокисляющих лучистых грибков, в частности микобактерий, менее ценный. Однако лучистые грибки, окисляющие углеводороды, способны синтезировать ряд ценных соединений. Это их свойство может быть использовано в народном хозяйстве. Например, как уже упоминалось, Mycobact. ceroformans превращает гексадекан в цетилпальмитат, кото-рый широко применяется в парфюмерной промышленности. Добывают это вещество из головного мозга кашалотов. Парафинокисляющие микобактерий синтезируют разнообразные витамины. Одни штаммы образуют витамины группы В, в частности рибофлавин. Другие накапливают каро-тиноиды — вещества, близкие к витамину А. Найдены и такие микобактерий, которые, окисляя углеводороды, выделяют в среду значительные количества аминокислот.
Известно несколько штаммов микобактерий, превращающих нафталин в салициловую кислоту, из которой приготовляют аспирин. В настоящее время при получении витаминов и аминокислот используется дорогое пищевое сырье, например сахара. Из приведенных примеров видно, что его можно заменить нефтяными углеводородами. Работа в этом направлении очень перспективна.
Есть еще одна область, в которой парафинокисляюгцие микобактерий могут сыграть существенную роль. За прошедшие 40 лет загрязнение нефтепродуктами рек, морей, океанов, почвы и атмосферы возросло во много раз. По данным американского журнала «National geografic magazin», каждый год выбрасывается в океаны от 3 до 10 млн. т нефти. Так, Тур Хейердал находил нефтяные шарики и пленку далеко в океане на протяжении всего плавания на «Ра-2».
К каким губительным последствиям для всего живого приводит загрязнение морей нефтью, показала гибель танкера «Торри Каньон», когда у берегов Корнуэлла погибло более 40 тыс. птиц, на многие километры были испорчены устричные поля и пляжи.
Эти примеры показывают, насколько острой стала проблема уничтожения нефтяных отходов. Химическая очистка нецелесообразна, так как приводит к накоплению еще более ядовитых соединений. Адсорбционные методы очистки также неэффективны из-за недостаточно глубокой очистки и трудности регенерации ионитов.
Наиболее перспективным является микробиологическое разрушение углеводородов нефти, приводящее к превращению их в нетоксичные кислородсодержащие вещества. Так, например, используя культуры активных парафинокисляющих микобактерий, можно во многих случаях предотвратить загрязнение биосферы нефтепродуктами. Такие культуры, как Mycobact. paraffinicum и Mycobact. lacticolum var. aliphaticum, прекрасно разлагают многие образцы нефти.
Учитывая имеющиеся данные о биосинтезе парафинокисляющими микроорганизмами витаминов, аминокислот, каротиноидов и других полезных метаболитов, можно предположить, что клеточная масса культур, разлагающих нефтяные отходы, может быть использована и в качестве удобрения. Микобактерий нашли применение также как активные продуценты аминокислот (см. также стр. 443). Наиболее широкое использование с целью получения глютаминовой кислоты получил вид Mycobact. glutamicum. Выделены также микобактерий, продуцирующие 1-валин.
Род микококки (MYCOCOCCUS)
Микококки — кокковые формы микроорганизмов, родственные актиномицетам; занимают промежуточное положение между микобакте-риями и микрококками, отличаются от микобактерий отсутствием палочковидной стадии развития, а от микрококков — неравномерным характером роста и деления клеток. В микробиологии существуют некоторые роды микроорганизмов, окруженные таинственным ореолом: со времени их первого описания не появлялось больше сведений о культурах этого рода, их не выделяли и не описывали заново, и многие микробиологи начинали даже сомневаться в существовании этих микроорганизмов в природе. К таким «таинственным» организмам относятся представители рода Мусоcoccus.
Впервые микококки были описаны Н. А. Кра-сильыиковым в 1938 г. По внешнему виду колоний и общей микроскопической картине микококки не отличались от микрококков, и только при более детальном изучении морфологии и цикла развития выяснилось, что микококки имеют специфические особенности, не свойственные микрококкам и сближающие их с представителями лучистых грибков.
Согласно описанию рода Mycococcus особенности эти состоят в следующем:
1. Клетки, как правило, в молодых культуpax имеют неправильные очертания, они могут быть угловатыми, неправильно шаровидными, овальными, картофелевидными, сдавленными с одной или нескольких сторон; палочковидные клетки обнаруживаются очень редко, и их длина не превышает двойной поперечник клетки.
2. В одной и той же культуре клетки резко отличаются друг от друга по величине.
3. Размножаются клетки не только делением, но и почкованием.
4. В старых культурах обнаруживаются покоящиеся формы — крупные клетки, резко преломляющие свет; такие клетки прорастают подобно спорам актиномицетов с образованием 1—3 ростовых трубок.
Процессы почкования и прорастания покоящихся форм свидетельствуют, по мнению Н. А. Красильникова, о родстве микококков с лучистыми грибками. О близости микококков к ветвящимся бактериям (коринеформам) впоследствии писали и другие авторы. Предположение о генетическом родстве микококков с лучистыми грибками, сделанное Красильни-ковым на основании сравнения циклов развития, было окончательно доказано им в процессе наблюдения за расщеплением культур микококков с образованием микобактериальных форм.
Многие культуры микококков в эволюционном развитии потеряли признаки, сближающие их с лучистыми грибками, поэтому только в процессе расщепления можно было опознать действительную природу организмов (Красиль-ников, 1938). Микобактериальные (палочковидные) формы появлялись чаще в старых культурах на очень богатых или очень бедных средах, предпочтительно жидких. Повышенная концентрация NaCl в среде также стимулировала процесс расщепления. Факт образования микобактериальных рас у микококков свидетельствовал, по мнению Красильникова, о том, что микококки произошли когда-то от микобактерий и в ходе исторического развития деградировали и приняли наиболее упрощенную форму, напоминающую микрококки.
Таким образом, микококки являются как бы связующим звеном между микобактериями и микрококками.
Микрококки рассматриваются Красильниковым как организмы, филогенетически связанные с лучистыми грибками, и включены им, как и микококки, в класс Actinomycetes (Красильников, 1949).
В отношении физиолого-биохимических свойств культуры микококков не обнаружили каких-либо особых свойств. Они хорошо росли как на синтетических средах с минеральным азотом, так и на белковых средах при рН 5—9; их ферментативная активность была выражена слабее, чем у микобактерий и проактиномице-тов; многие виды микококков могли расти при 7 —12% NaCl в среде и были устойчивы к высушиванию. Было описано 10 видов рода Мусосос-cus, выделенных из почв и различающихся по пигментации и культурально-физиологическим признакам. При описании рода отмечалось, что микококки реже встречаются в почве, чем микобактерий или микрококки (Красильников, 1938).
Со времени первого описания рода в течение 30 лет в печати, как в советской, так и в зарубежной, не появлялось больше сообщений о микококках. В каждое новое издание определителя Берги переписывалось без всяких изменений описание рода Mycococcus, данное Н. А. Красильниковым в 1938 г. Типовые культуры микококков не сохранились, неотиповые культуры не были предложены. Поскольку описание рода Arthrobacter (Bergey, 1957) близко к описанию рода Mycococcus (Красильников, 1949), а новых работ, характеризующих микококки, нет, то высказывалась мысль о пересмотре законности существования этого рода. Ваксман предположил, что микококки представляют собой скорее мутанты или штаммовые варианты Actinomycetales, чем истинный вид или род.
Лишь в самые последние годы появилось несколько работ, в которых сообщается о новом выделении культур, близких описанию рода Mycococcus. Из организма человека были выделены кокки, образующие значительные количества перекиси водорода и определенные как микококки. В описании морфологии этих организмов сообщалось о размножении их путем деления и почкования. Поскольку по физиолого-биохимическим свойствам исследуемые кокки несколько отличались от всех известных видов Mycococcus и образовывали значительные количества перекиси водорода, было предложено выделить их в новый вид — Mycococcus hyperoxidans.
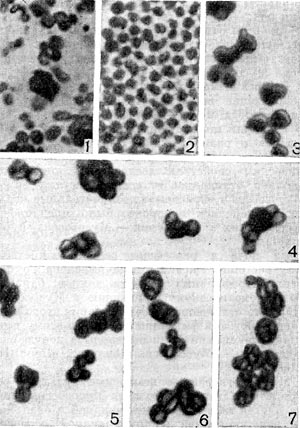
Рис. 108. Клетки мпкококков в световом микроскопе: 1—3 — варьирование размеров и очертаний клеток, фазовый контраст; 4 — образование конгломератов неопределенной конфигурации; 5 — «почкующиеся» клетки микококков; 6—7 — дробление клеток в конгломератах. Окраска клеточной стенки по Гутштейну. Увел. X 3600.
Из почв и ризосферы сельскохозяйственных растений Украины была выделена группа олигонитрофильных штаммов кокков, близких по систематическому положению к Mycococcus albus, но отличающихся от описания этого вида способностью к фиксации азота. По этому признаку микококки были выделены в новую разновидность — Mycococcus albus var. oligonitrofilus.
Морфологически описываемые культуры соответствовали описанию рода Mycococcus, форма клеток менялась от шаровидной и овальной до веретеновидной и лимоновидной; встречались ответвления и боковые выросты на клетках; наблюдалось варьирование в размерах клеток. Из рубцового отдела желудка коровы была выделена термотолерантная кокковидная культура, активно растущая на средах с парафинами. На основании изучения морфологических признаков культура была отнесена к роду Mycococcus. Авторы отмечали полиморфизм клеток в культуре этого организма и размножение путем деления, перешнуровывания и почкования, свойственного микококкам по описанию. По культурально-физиологическим признакам исследуемый организм был близок к виду Mycococcus lactis (Красильников, 1949), но отличался от описания этого вида повышенным температурным оптимумом роста (38— 43 °С) и способностью активно расти на средах с парафинами, выделяя при этом флавины.
При исследовании микрофлоры ризосферы в числе прочих микроорганизмов была выделена культура, соответствующая по морфологии микококкам и отнесенная к виду Mycoccocus lactis. При изучении микрофлоры литофильных (растущих на камнях) лишайников, покрывающих горы Памира и Тянь-Шаня, было обнаружено, что характерными компонентами литайниковых ценозов этих высокогорных районов являются пигментные кокковидные формы микроорганизмов. Среди последних были найдены и микококки.
Морфология и тонкое строение микококков
Клетки микококков значительно варьируют по величине (от 0,5 до 3—4 мкм) в одной и той же культуре, имеют разнообразную форму — шаровидную, овальную, клиновидную, треугольную, часто они как бы сдавлены с одной или нескольких сторон (рис. 108).
На ранних стадиях развития кокки собраны в конгломераты неопределенных конфигураций либо искривленные цепочки (рис. 108,4). Встречаются сочетания мелкой и крупной клеток, соединенных вместе, либо двух мелких клеток, прикрепленных с обеих сторон к большой клетке, что напоминает материнскую клетку с почками.
При окраске клеточных стенок кокков обнаружилось, что (рис. 108,5) крупные клетки (2—4 мкм), принимаемые в фазовом контрасте за единичные, представляют на самом деле конгломераты клеток, объединенных общей оболочкой. Внутри такой клетки-колонии видны беспорядочно расположенные перегородки (рис. 108, 6, 7).
Длительное непрерывное наблюдение за развитием культур дало возможность выявить определенный цикл развития. В первые часы роста образуются макроформы, представляющие агрегаты клеток, объединенные общей оболочкой. В последующем эти образования распадаются на отдельные клетки различной формы и величины. При этом на всех стадиях развития наблюдается неравномерный характер роста и деления (дробления) клеток. Даже шаровидные мелкие клеточки, образующиеся на конечных этапах дробления, приобретают перед каждым последующим делением треугольную форму, напоминая первые этапы прорастания спор актиномицетов тремя проростками.
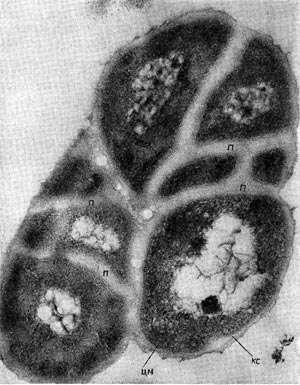
Рис. 109. Ультратонкий срез клеток Mycococcus species, демонстрирующий специфический способ деления микококков. Увел. X 60 000. п — перегородки; цм — цитоплазматическая мембрана; кс — клеточная стенка.
У некоторых штаммов с красно-розовой пигментацией культур обнаруживаются подвижные клетки. Они появляются при окончательном разделении конгломератов на единичные клеточки и имеют всегда правильно шаровидную форму. Подвижность сохраняется в 7 — 8-суточных культурах. Постоянное нахождение в препаратах исследуемых штаммов «почкующихся» клеток позволило предположить размножение этих организмов почкованием, что свойственно, по описанию, микококкам. Однако в результате наблюдения за развитием отдельных клеток в камере было показано, что микококки размножаются путем неправильного дробления, а не почкования.
Появление сочетаний клеток, похожих на материнские клетки с почками, оказалось результатом специфического неравномерного роста и деления исследуемых организмов.
Из всех известных кокковых форм неравномерный характер роста и деления описан только у клеток кокковидной стадии развития микобактерий. Как и для описываемых культур, для них характерен такой же неравномерный рост кокков, приводящий к формированию клиновидных клеток, и расположение перегородок под углом друг к другу, сопровождающееся образованием искривленных цепочек или неправильных скоплений клеток. Однако кокковидные клетки микобактерий при перенесении в свежую среду прорастают в палочки, в то время как у исследуемых культур палочковидная стадия развития не появлялась ни при каких условиях культивирования.
Клетки микококков имеют все характерные для прокариотных микоорганизмов структуры: клеточную стенку, цитоплазматическую мембрану, цитоплазму, содержащую различные включения, внутрицитоплазматические мембранные структуры и нуклеоид. Клеточные стенки имеют строение, характерное для грам-положительных организмов. Они состоят из двух электронно-плотных слоев и более широкого светлого слоя между ними (рис. 109 и 110). У некоторых штаммов отдельные участки клеточной стенки были сильно утолщены и имеют рыхлое, аморфное строение. Цитоплазма обычно мелкогранулярная и состоит из плотно упакованных рибосом. Внутри цитоплазматиче-ские мембранные системы трубчатого, ламелярного, а у некоторых штаммов и везикулярного типа. Нуклеоид занимает участки различных размеров и форм и имеет фибриллярное строение.
Изучение тонкого строения микококков дало возможность наблюдать необычный для кокков способ деления, предполагаемый при исследовании культур в световом микроскопе. Оказалось, что всем представителям микококков свойственно неравномерное, неправильное деление (дробление) клеток на несколько частей.
Рис. 110. Ультратонкие срезы микококков (Mycococcus species). Видно дробление клеток. Увел. X 30 000.
Перегородки закладываются сразу в нескольких участках клеточной стенки без какой-либо закономерности и растут центрипетально, дробя клетку на секции разной величины и формы (рис. 109 и 110). В одной клетке может образоваться от трех до десяти перегородок, а их беспорядочное расположение обусловливает образование причудливо расчлененной крупной клетки-колонии. Каждая клеточка в такой клетке-колонии имеет свою мембрану и внутренний слой клеточной стенки. Внешний слой клеточной стенки является общим для всех клеточек и при отделении их друг от друга, по-видимому, формируется заново.
Иногда септы (перегородки) могут располагаться параллельно друг другу; в других случаях они отчленяют краевые участки клетки, имеющие серповидную или треугольную форму. Встречается и радиальное расположение перегородок. Со временем крупная клетка-колония дробится на отдельные части по этим перегородкам, распадаясь на все меньшие и меньшие агрегаты клеток неопределенной конфигурации.
Неравномерное деление (дробление) клеток было обнаружено у некоторых представителей класса лучистых грибков. Таким образом, размножение микроорганизмов путем неравномерного деления свойственно некоторым культурам кокков и актиномицетов, включая и микококки.
Физиолого-биохимические особенности микококков
Микококки являются аэробными гетеротрофными, грамположительными организмами, растущими при температуре от 10 до 30 °С и обладающими слабой ферментативной активностью. Культуры микококков, выделяемые из почв, хорошо растут на синтетических средах с минеральным источником азота. Микококки, обитающие в лишайниках, требуют при культивировании аминокислот и витаминов в качестве ростовых факторов, что связано, по-видимому, с их экологией.
Представители рода Mycococcus, выделяемые из почв и лишайников, большей частью окрашены в красные, розовые и желтые тона за счет внутриклеточных пигментов, образуемых этими культурами. Изучение физико-химических свойств пигментов показало, что они относятся к группе кислородсодержащих кароти-ноидов.
Культуры микококков, выделяемые из организма человека и животных, как правило, беспигментные.На микококках из литофильных лишайников впервые было проведено определение нуклео-тидного состава ДНК рода Mycococcus. Оказалось, что содержание ГЦ пар в ДНК у представителей рода Mycococcus колеблется от 62,3 до 69,4 мол.%. Если учесть, что содержание ГЦ в ДНК различных родов класса актино-мицетов колеблется от 62 до 78 мол.%, то по этому признаку род Mycococcus оказался близким к лучистым грибкам. Род Micrococcus характеризуется также близкой величиной нуклеотидного состава (57—75 мол.% ГЦ).
В клеточных стенках микококков в качестве основных аминокислот был обнаружен лизин в сочетании с аспарагиновой кислотой и глицином, а из Сахаров — галактоза и арабиноза. Учитывая одновременно морфологические особенности и химический состав клеточных стенок, можно сказать, что в близком родстве с ми-кококками находятся микрококки и микобак-терии. Это подтвердилось и данными инфракрасной спектроскопии. Интересным явилось обнаружение у микококков фермента поли-фосфатглюкокиназы. Этот фермент был найден лишь у представителей класса актиномицетов и не был обнаружен ни у истинных бактерий, ни у водорослей. Присутствие полифосфатглюкокиназы в культурах микококков еще раз доказывает их родство с лучистыми грибками, установленное Н. А. Красильниковым на основании морфологии и изменчивости культур микококков.
Изучение морфологии, тонкого строения и биохимических особенностей микококков с помощью современных методов исследования позволило выявить новые, ранее не описанные свойства. В связи с этим в настоящее время внесены следующие дополнения в диагноз рода Mycococcus. Клетки микококков сферические, но имеют неправильные, угловатые очертания; размеры клеток в одной и той же культуре варьируют от 0,5 до 3—4 мкм. Большей частью коккоиды собраны в агрегаты неопределенной конфигурации или искривленные цепочки.
Палочковидная стадия развития отсутствует. Клеткам микококков свойствен неравномерный характер роста. Размножение происходит путем неравномерного деления (дробления) клетки на несколько частей. Встречаются подвижные формы, имеющие всегда правильно шаровидную форму клеток. По внешнему виду колоний культуры микококков не отличаются от культур микобактерий или микрококков. По Граму, окрашиваются положительно, аэробы. Нуклеотидный состав ДНК колеблется от 62 до 69 мол.% ГЦ. Пигменты окрашенных форм относятся к группе кислородсодержащих каротиноидов. Клеточные стенки содержат лизин, аспарагиновую кислоту, глицин, а из Сахаров — арабинозу и галактозу.
Экология микококков и их значение в природе и жизни человека
В настоящее время имеется весьма небольшое число сведений о распространении микококков. Известно, что микококки были выделены из почв, лишайников, ризосферы и листьев растений, из организма человека и животных. Из этого следует, что, по-видимому, они довольно широко распространены в природе. При изучении состава почвенной микрофлоры, возможно, их путали с микрококками. Выделенные из ризосферы сельскохозяйственных растений микококки фиксировали азот атмосферы в довольно значительных количествах, участвуя тем самым в снабжении азотом растений наряду с другими азотфиксаторами.
Обитающие в литофильных лишайниках микококки оказались способными, как и сами лишайники, к поглощению и аккумуляции в клетках радиоактивных веществ. Особый интерес представляют микококки, выделенные из организма человека и животных и образующие перекись водорода (Н202). Сотрудниками кафедры микробиологии Днепропетровского медицинского института было показано, что микококки — продуценты H202 — часто выделяются из тканей новообразований и из органов животных, облученных рентгеном. Облучение, столь важное в терапии рака, может быть, по-видимому, полностью заменено воздействием эквивалентного количества перекиси водорода, поскольку действие облучения состоит лишь в том, что оно вызывает образование H202. Предполагается, что попадание продуцентов Н2О2 в ткань новообразований имеет в своей основе защитный механизм.
Порядок кокки (COCCALES)
Название «кокки» было предложено для бактерий, имеющих сферическую форму клетки (от греч. «коккус» — ягода). Человек, сам того не подозревая, постоянно сталкивается в своей жизни с кокковидными микроорганизмами. Кокки находятся в воздухе, которым мы дышим, в земле, по которой мы ходим, в цветах, которые мы собираем, в воде рек и морей, в пище, которую мы едим, и даже в нашем организме. Одни виды кокков полезны для человека — их используют в производстве молочных продуктов (кефира, масла, сыров), при приготовлении силоса; они участвуют в круговороте веществ в природе, разлагая различные отмершие остатки растений и животных и выполняя тем самым роль «мусорщиков»; они стимулируют рост культурных растений, снабжая их витаминами и гетероауксинами. Другие виды кокков издавна наносили большой вред человеку, являясь источником заражения и нагноения ран, вызывая такие тяжелые заболевания, как крупозная пневмония, менингит, гоноррея и др. Развиваясь в некоторых молочных, мясных и рыбных продуктах, некоторые кокки выделяют в среду сильнейший яд — энтеротоксин — и вызывают тем самым пищевые отравления людей.
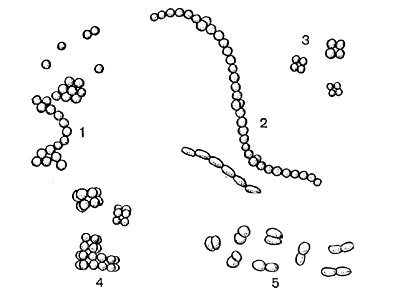
Рис. 111. Родовая принадлежность кокков в зависимости от расположения клеток после деления: 1 — Micrococcus; 2 — Streptococcus; 3 — Gaffkya; 4 — Sarcina; 5 — Diplococcus.
Если посеять пробы воды, почвы, кусочки растений, слюну, гной людей или животных, зараженных патогенными кокками, на специальные твердые питательные среды, мы увидим разнообразные колонии. У патогенных кокков колонии, как правило, невзрачные (мелкие и бесцветные); у сапрофитных форм часто обнаруживаются красивые колонии, окрашенные в яркие красные, розовые, оранжевые и синие тона. Особенно много пигментных форм кокков в воздухе, на поверхности высших растений и литофильных (растущих на камнях) лишайников, т. е. там, где они подвержены действию солнечной радиации. Предполагают, что пигменты, вырабатываемые микроорганизмами, выполняют защитные функции.
Сапрофитные формы кокков довольно неприхотливы: они растут в широком диапазоне температур (от 10 до 45 °С), развиваются на обычных пептонных средах, некоторые виды обитают в местах с повышенными концентрациями солей, другие устойчивы к радиоактивному излучению. Обитающие в организме человека кокки адаптировались к паразитическому образу жизни и трудно поддаются культивированию, требуя особых условий влажности, температуры, сложных питательных веществ.
Если посмотреть под микроскопом, мы увидим, что колонии кокков состоят из множества мелких округлых клеточек. Величина их может варьировать от 0,2 до 2,5—3 мкм, но чаще всего встречаются клетки от 0,5 до 1 мкм. Изучать такие мелкие организмы в световом микроскопе довольно сложно. Несмотря на то что само название «кокки» предполагает сферическую форму клетки, у некоторых кокков клетки имеют несколько удлиненную, ланцетовидную форму (у «молочных» стрептококков) или форму кофейных зерен (у гонококков). Цикл развития кокков крайне прост: клетка делится на две равные кокковидные клетки. Такой простой жизненный цикл осложняет систематизацию кокковых форм, к тому же почти все кокки (за небольшим исключением) неподвижны, не образуют спор, большей частью грамположи-тельны.
Какие же признаки могут служить дифференцирующими при разделении кокков на таксоны? Оказалось, что в зависимости от того, в какой плоскости происходит деление клетки, кокки располагаются после деления либо в виде цепочек, либо тетрад, либо пакетов или скоплений неправильной формы.
Еще в 1900 г. Мигула разделил кокки на 5 родов на основании способа деления, а также подвижности:
Streptococcus — цепочки кокков, деление в одной плоскости;
Micrococcus — одиночные или в неправильных скоплениях кокки;
Sarcina — правильные пакеты, деление в трех взаимно перпендикулярных направлениях;
Planosarcina и Planococcus — подвижные сарцины и микрококки.
До сих пор во всех современных учебниках и руководствах по микробиологии приводятся традиционные рисунки различных сочетаний кокковидных клеток, характеризующих определенный род (рис. 111).
В широко используемом в нашей стране «Определителе бактерий и актиномицетов» Н. А. Красильникова все кокки, объединенные в одно семейство Соссасеае (порядок Соссасеае, класс Actinomycetes), подразделяются на роды по следующим признакам: клетки одиночные — род Micrococcus, клетки соединены в пары — род Diplococcus, в цепочки — род Streptococcus, в пакеты — род Sarcina. Таким образом, видно, что распределение по родам основано на том же морфологическом, легко обнаруживаемом признаке. Роды Neisseria и Nitroso-coccus, также включенные Н. А. Красильнико-вым в семейство Соссасеае, выделяются по другим свойствам — окраске по Граму и автотрофному типу питания соответственно.
В настоящее время известно свыше 15 родов кокков. Некоторые роды — Gaffkya, Pediococcus, Staphylococcus — были описаны очень давно, но считались ранее синонимами рода Micrococcus. Род Leuconostoc рассматривался Н. А. Красильниковым как вид, входящий в род Streptococcus. При увеличении количества родов семейства Соссасеае одного морфологического признака оказалось недостаточно для дифференциации кокковых форм, поэтому стали использоваться в качестве диагностических такие признаки, как окраска по Граму, отношение к кислороду, тип метаболизма, патогенность и др. Многие авторы предлагают выделять уже не одно, а несколько семейств кокков. Так, в определителе бактерий Берги кокки распределены по трем семействам: Micrococcaceae, Neisseriaceae и Lactobacillaceae — триба Streptococcaceae. Род Nitrosococcus помещен в семейство Nitrobacteriaceae.
Ниже мы приводим краткую характеристику основных родов кокков.
Роды диплококки (DIPLOCOCCUS), стрептококки (STREPTOCOCCUS), педиококки (PEDIOCOCCUS), леиконосток (LEUCONOSTOC), пептострептококки (PEPTOSTREPTOCOCCUS)
Эти роды объединены по определителю бактерий Берги в трибу Streptococcaceae, семейство Lactobacillaceae. Общие признаки перечисленных выше родов: грамположительные, образуют цепочки, неподвижные, кокки, микроаэрофилы или факультативные анаэробы, каталазу не образуют, энергетический метаболизм протекает по типу брожения, нуждаются в сложных питательных веществах. Род Streptococcus. Этот род включает в себя:
1) пиогенные (гноеродные) стрептококки — патогенные для человека и животных;
2) фекальные стрептококки
и 3) безвредные «молочные» стрептококки.
Пиогенные стрептококки адаптированы к паразитическому образу жизни в организме млекопитающих. Их выращивают при 37 °С в бульоне с сывороткой и кровью в атмосфере, содержащей 5—10% С02. Типичный представитель группы пиогенных стрептококков — Str. pyogenes. Здесь и далее родовое название видов Streptococcus дается сокращенно Str. Он служит возбудителем скарлатины, ангины, послеродового сепсиса и других тяжелых эпидемических инфекций человека. Str. agalactiae вызывает в основном инфекции у крупного рогатого скота.
Фекальные стрептококки обнаруживаются в испражнениях человека и животных. Некоторые из них постоянно живут также в полости рта, откуда и попадают в кишечник. Str. salivarius встречается в основном у человека; Str. bovis — только у рогатого скота; Str. equinus — у лошадей и других животных.
В эту же группу входят более устойчивые энтерококки, обнаруживаемые в кишечнике человека и животных, навозе, молочных продуктах. Они часто образуют скопления, напоминающие скопления микрококков. Типичный представитель энтерококков — Str. faeca-lis. Все энтерококки хорошо растут при температуре 22—40 °С на обычных мясных средах. Поскольку фекальные стрептококки постоянно присутствуют в кишечнике человека, сохраняют жизнеспособность во внешней среде, легко культивируются и идентифицируются, их принято считать индикаторами фекального загрязнения.
Стрептококки «молочной» группы вызывают скисание молока и играют важную роль в молочной и пищевой промышленности. Они быстро растут в молоке при 28 °С, вызывая его свертывание. Типичные представители «молочных» стрептококков — Str. lactis, Str. cre-moris и Str. thermophilus. Последний выдерживает температуру 63 °C и используется для получения сыров, которые готовят при относительно высокой температуре.
Род Diplococcus
К этому роду относится единственный вид — Diplococcus pneumoniae, вызывающий крупозную пневмонию и другие тяжелые инфекции — менингит, септицемию, перитонит.
Диплококки содержатся в слюне и мокроте больных крупозной пневмонией, обнаруживаются также в полости рта и носоглотке здоровых людей. Культивируются они так же, как и пиогенные стрептококки.
Род Leuconostoc
Название микроорганизмов этого рода происходит от названия сине-зеленых водорослей — Nostoc и от греческого слова «лейкос» — бесцветный. Бактерии рода Leuconostoc напоминают водоросли Nostoc тем, что образуют переплетающиеся цепочки, состоящие из сферических клеток, окруженных толстой капсулой, но лишены хлорофилла в отличие от водорослей. Представители рода Leuconostoc относятся к гетероферментативным микроорганизмам. L. mesenteroides и L. dextranicum сбраживают квашеную капусту, силос и соки в процессе производства сахара. Они наносят ущерб сахарной промышленности, образуя слизи и камеди, засоряющие чаны и трубопроводы.
L. citrovorum в сочетании со Str. lactis и Str. cremoris добавляют к молоку и сливкам, идущим на производство масла и сыра, так как этот организм расщепляет лимонную кислоту с образованием диацетила, придающего приятный вкус сливочным маслам.
Род Peptostreptococcus
Клетки в парах или цепочках, неподвижны, грамположительны. Анаэробы. Разрушают различные вещества, содержащие протеины, органические кислоты и углеводы с образованием СО2, Н2 и других продуктов. Обнаруживаются в дыхательных путях и пищеварительном тракте человека и животных. Встречаются патогенные виды. Типовой вид — Peptostreptococcus anaerobius, выделяется он из гангренозных очагов, аппендикса, крови.
Род Pediococcus
К этому роду относятся гетероферментативные микроаэрофильные кокки. Поскольку они часто образуют скопления кубовидной формы наряду с цепочками кокков, их называли иногда сарцинами.
Педиококки развиваются в бродящих растительных продуктах, главным образом в пиве и пивном сусле. Пиво скисает и мутнеет, приобретает неприятный вкус и запах. Типовой вид — Pediococcus serevisiae.
Роды микорококки (MICROCOCCUS), стафилококки (STAPHYLOCOCCUS), гафуия (GAFFKYA), сарцины (SARCINA), метанококки (METHANOCOCCUS), пептококки (PEPTOCOCQJS)
Эти роды объединяются в семейство Micro-соссасеае по определителю Берги.
Общие признаки вышеперечисленных родов: грамположительные, большей частью свободно-живущие сапрофитные кокки с правильно сферической формой клеток. За исключением Peptococcus, все они растут в широком диапазоне температур (22—40°С), в самых разнообразных условиях: в инфицированных тканях, грязи, молочных и мясных продуктах, в почве, пыли, воздухе, морской и речной воде, на поверхности растений. Все они гетеротрофы и хорошо растут на обычных пептонных средах. Много встречается окрашенных форм.
Род Micrococcus
Клетки в неправильных скоплениях, у некоторых видов наблюдаются подвижные клетки. Одни виды бесцветные; другие образуют пигмент оранжевого, желтого или красного цвета. Сапрофиты или факультативные паразиты, патогенных видов нет. У большинства видов оптимум температуры 25—30 °С, хотя для Micr. cryophilus оптимальная температура -|-100С. Большинство микрококков довольно устойчивы к высушиванию и нагреванию; Некоторые виды (Micr. morrhuae и Micr. halodenitrificans) галофильны и могут расти в среде, содержащей до 20—30% NaCl. Распространены повсеместно — в почве, воздухе, воде, пищевых продуктах. Разлагая органические остатки, содержащие белки, с образованием аммония, микрококки выполняют тем самым роль «мусорщиков». Micr. ureae разлагает мочевину до аммонийных солей, a Micr. colpogenes, обитающий в морской воде, разрушает хитин. Виды Micr. denitrificans и Micr. halodenitrificans редуцируют нитраты и нитриты до свободного азота, участвуя в круговороте азота в природе. Типовой вид рода — Micr. luteus.
Род Staphylococcus
Представители этого рода отличаются от микрококков тем, что являются факультативными анаэробами и вызывают ферментацию глюкозы в анаэробных условиях с образованием кислоты, кроме того, многие виды стафилококков патогенны. Большинство видов требуют органических источников азота и витаминов для роста. Многие штаммы образуют оранжевый или желтый пигмент. Типовой вид рода — Staphylococcus aureus. Staphylococcus aureus — возбудитель гнойных инфекций, он может вызывать маститы, фурункулезы, абсцессы внутренних органов. Staphylococcus epidermidis — менее вирулентный возбудитель тех же инфекций.
Стафилококки нередко вызывают пищевые отравления, что связано с их способностью вырабатывать яды — энтеротоксины. При попадании токсинов в желудочно-кишечный тракт возникают тошнота, рвота, понос.
Встречаются чаще всего на коже и слизистых теплокровных животных, в различных пищевых продуктах, воздухе. Сапрофитные стафилококки трудно отличить от микрококков.
Род Gaffkya
Представители этого рода характеризуются тем, что образуют тетрады клеток, часто окружены толстыми капсулами. Аэробы и факультативные анаэробы. Оптимум температуры 37 °С. Патогенны для мышей и некоторых других животных. Типовой вид — Gaffkya tetragena.
Род Sarcina
Деление клеток в трех взаимно перпендикулярных направлениях обусловливает образование правильных пакетов кокков, характерных для представителей этого рода. Следует отметить, что род этот весьма гетерогенный. В него входят как неподвижные, так и подвижные виды (Sarcina ureae), как аэробные, так и облигатно анаэробные виды. В связи с этим род Sarcina подразделяется на подроды:
1. Подрод Zymosarcina — микроаэрофилы или анаэробы, используют сахара, не образуют метан. Сюда входят виды Sarcina ventriculii и Sarcina maxima. Интересно, что пакеты Sarcina ventriculii склеены веществом, состоящим из целлюлозы, выделяемой клетками этого вида.
2. Подрод Methanosarcina — анаэробы, не используют Сахаров, образуют метан из CО2. Сюда относятся виды Sarcina methanica и Sarcina barkeri.
3. Подрод Sarcinococcus — аэробы, не превращают мочевину в аммонийные соли. Сюда входят наиболее часто встречающиеся в воздухе, воде и почве виды: Sarcina lutea, Sarcina flava (желтый пигмент), Sarcina auran-tiaca (оранжевый) и Sarcina litoralis (красный пигмент) — галофильный вид.
4. Подрод Urosarcina — аэробы, превращают мочевину в аммонийные соли. Представитель этого подрода — Sarcina urea — интересен тем, что образует эндоспоры. Последние локализуются в центре клетки. Кроме того, клетки этого вида подвижны и имеют по одному длинному жгутику. Все виды сарцин относятся к сапрофитам или факультативным паразитам. Как и микрококки, они участвуют в круговороте веществ в природе.
Род Methanococcus
Клетки единичные, в парах или агрегатах. Подвижны или неподвижны. Грамвариабильны. Отличительный признак рода — разложение различных органических соединений с образованием метана. Анаэробы. Сапрофиты. Типовой вид — Methanococcus mazei. Метанококки обитают в болотах и отстоях сточных вод, образуют метан (болотный газ), СО-2, а иногда и водород.
Род Peptococcus
Клетки единичные, в парах, тетрадах, агрегатах. Неподвижные, грам-положительны. Облигатные анаэробы, обладающие протеолитической активностью и ферментирующие разнообразные органические соединения. Оптимум температуры 37 °С. Типовой вид — Peptococcus niger, образующий пигмент черного цвета. Обитают в испражнениях, грязи, в человеческом организме и способны при определенных условиях вызывать септические инфекции.
Роды нейссерия (NEISSERIA) и веилонелла (VEILLONELLA)
По определителю Берги эти роды объединяются в семейство Neisseriaceae. Грамотрицательные неподвижные кокки, большей частью паразиты человека, оптимум температуры 37 °С.
Neisseria
Neisseria — мелкие аэробные диплококки, напоминают по форме кофейные зерна. Микроорганизмы этого рода — классический пример хрупких бактерий, высокоадаптированных к паразитическому образу жизни. Они не могут долго сохраняться вне организма, при высушивании погибают, растут лишь на мясной среде с кровью при высокой влажности, температуре 35—37 °С, в атмосфере, содержащей 5—10% С02.
В отличие от широко распространенных представителей Micrococcaceae, Neisseria обнаруживаются лишь в верхних дыхательных путях человека. Исключение составляет N. gonorr-haeae (гонококки) — возбудитель гонорреи, размножающийся в мочеполовом тракте. N. meningitidis (менингококки) вызывает эпидемический цереброспинальный менингит.
Существуют и сапрофитные представители Neisseria — N. flava, N. catarrhalis и N. sicca. Они развиваются в организме млекопитающих, но безвредны.
Род Veillonella
Род Veillonella — грамотрицательные анаэробные кокки, обитающие в полости рта здоровых людей и животных. Изучены мало. Сравнительно недавно описаны два рода кокков, еще не вошедшие в определители.
Род Aerococcus
Род Aerococcus — кокки, обычно загрязняющие воздух. Выделены в особый род на основании устойчивости к 40% желчи и кристалл-виолету. Выживают при 60 °С в течение 30 мин, растут только в щелочной среде при рН 9, грамположительны.
Род Methylococcus
Род Methylococcus — диплококки или цепочки кокков, грамотрицательны. В отличие от метанобразующих бактерий приставка Methyl обозначает — метанокисляющие. Кроме метана, культуры этого рода могут использовать и метанол. Предполагается выделить этот род вместе с другими метанокисляющими бактериями в отдельное семейство — Methylobacteriaceae.
Новые подходы к таксономии Соссасеае
В настоящее время большинство исследований по систематике кокков касаются наиболее широко распространенных в природе представителей родов Micrococcus, Staphylococcus и Sarcina. Стафилококков постоянно выделяют из организма человека и животных, воздуха, различных пищевых продуктов; микрококков и сардин — из почвы, воздуха, воды, растений.
Начиная с конца прошлого столетия и до настоящего времени ведутся постоянные поиски признаков, которые бы дали возможность четко разграничить два больших рода — Micrococ-cus и Staphylococcus, представляющих яркий пример дихотомии в бактериальной классификации. В качестве дифференцирующих родовых признаков использовались самые разнообразные свойства — патогенность, термоустойчивость, антигенный состав, чувствительность к антибиотикам. Многие исследователи пытались, наоборот, объединить роды Staphylococcus и Micrococcus в один род и производить лишь деление на виды.
Большой вклад в систематику кокков внес английский микробиолог Бэрд Паркер, исследовавший свыше тысячи культур кокков, выделенных из самых разнообразных источников — почвы, воздуха, молока, поверхности растений, организма человека и животных. Первоначально все исследуемые культуры кокков были отнесены им к трем родам — Staphylococcus, Micrococcus и Sarcina; в свою очередь, каждый род был поделен на несколько групп на основании физиолого-биохимических особенностей. Все культуры были исследованы в сравнительном аспекте с использованием общепринятых методов, рекомендуемых для диагностики бактерий обществом американских бактериологов. Были введены и новые признаки для характеристики групп — химический состав клеточных стенок и чувствительность к лизоциму. Роды Staphylococcus и Micrococcus разграничивались на основании анаэробной ферментации глюкозы. Представители рода Staphylococcus способны в анаэробных условиях ферментировать глюкозу с образованием кислоты, в то время как культуры рода Micrococcus не обладают таким свойством. Использование этого теста для разграничения вышеуказанных родов было принято официально подкомитетом по таксономии Micrococcaceae в 1964 г. Принадлежность культур к роду Sarcina устанавливалась по способности кокков образовывать правильные пакеты клеток. Однако и Бэрд Паркер, и другие авторы отка-..зались от выделения аэробных пакетообразую-щих кокков в самостоятельный род Sarcina.
Исследования последних лет показали, что анаэробная ферментация глюкозы не является надежным признаком для дифференциации микрококков и стафилококков. Начались поиски новых тестов. Большие исследования проведены по изучению нуклеотидного состава ДНК кокков чешскими авторами (Коцур, Мартинек, Мазанек и др.). В результате удалось разграничить по этому признаку два больших рода — Micrococcus и Staphylococcus установлено, что у представителей рода Staphylococcus молярный процент ГЦ в ДНК колеблется от 30,7 до 36,4, в то время как у представителей рода Micrococcus — от 65 до 75. Впоследствии было предложено расширить предел колебаний величины ГЦ для рода Micrococcus от 57 до 75 мол. % . Культуры микрококков, у которых содержание ГЦ было значительно ниже предела, установленного для рода Micrococcus (39—51 мол. %), предложено выделить в особый род — Pianococcus.
Исследование состава оснований ДНК у сар-цин показало, что они не отличаются по нук-леотидному составу от представителей рода Micrococcus. Исследователи, изучавшие кокковые формы микроорганизмов, уже давно отмечали, что образование пакетов культурами аэробных кокков не является стабильным признаком: при определенных условиях культивирования аэробные сарцины теряют способность к образованию пакетов. Следовательно, пакетообразование не может служить ценным критерием для разделения родов Micrococcus и Sarcina. По физиологическим и культураль-ным признакам и нуклеотидному составу ДНК аэробные сарцины не отличаются от микрококков. На основании этого предложено аэробные пакетообразующие кокки исключить из рода Sarcina и перенести их в род Micrococcus. Родовое название Sarcina в таком случае сохраняется за анаэробными видами сарцин, стабильно образующими пакеты и имеющими в составе оснований ДНК 28—30 мол. % ГЦ. В последней сводке по нуклеотидному составу кокков даются пределы колебаний ГЦ для каждого рода кокков.
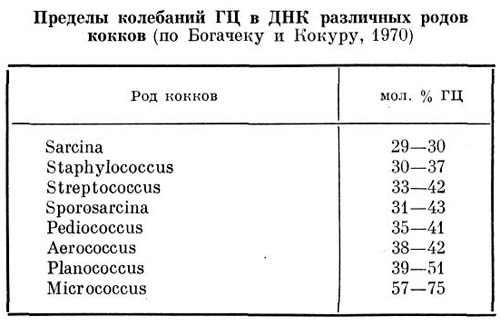
Оказалось, что с нуклеотидным составом ДНК коррелирует и содержание менахинонов. Менахиноны (витамины группы К), связанные с электронным транспортом у бактерий, были обнаружены у всех микрококков и стафилококков, но в разных количествах, от нескольних микрон до более чем 400 мкг. В менахинонах разных микроорганизмов может содержаться от 6 до 9 изопреновых единиц. Однако мена-хиноны, состоящие из 6 изопреновых единиц, были обнаружены только у представителей рода Micrococcus, в то время как микроорганизмы из рода Staphylococcus содержали мена-хиноны только с 9 изопреновыми единицами. Содержащие водород менахиноны были обнаружены только у пигментированных микрококков, характеризующихся наивысшим содержанием ГЦ.
Последнее время в качестве таксономического признака все чаще используется химический состав клеточных стенок микроорганизмов. Были сделаны попытки определить и сравнить химический состав клеточных стенок и у кокков. Характерной общей особенностью для микрококков и стафилококков является отсутствие диаминопимелиновой кислоты в клеточных стенках, вместо нее присутствует лизин. По мере продвижения от подгрупп рода Staphylococcus к подгруппам рода Micrococcus, выделенным Бэрд-Паркером, упрощается аминокислотный состав пептидов. Набор Сахаров, напротив, более полный у микрококков высших групп. Интересно, что в пептидогликанах клеточных стенок стафилококков присутствуют связи глицин-глицин, в то время как в пептидных цепочках культур рода Micrococcus такие мостики отсутствуют. Чувствительность культур рода Staphylococcus к антибиотику лизостафину объясняется воздействием этого антибиотика на глициновые мостики; микрококки же устойчивы к действию лизостафина. Таким образом, четкое разграничение родов Micrococcus и Staphylococcus становится все более вероятным на основании нуклеотидного состава ДНК, химического состава клеточных стенок, содержания менахинонов и других признаков современной таксономии.
Тонкое строение кокков. Способ деления
Принципиальное строение клеток кокков в целом не отличается от такового у других прокариотных микроорганизмов. Клетки кокков состоят из клеточной стенки, цитоплазма-тической мембраны, цитоплазмы с различными включениями и нуклеоида.
У кокков развиты внутрицитоплазматиче-ские мембранные структуры, имеющие разное строение — ламеллярное, трубчатое, везикулярное. Внутрицитоплазматические мембранные структуры (мезосомы) часто связаны с нуклеоидом или заключены в пего. Мезосомы находятся в контакте с растущими перегородками, и существует предположение, что они участвуют в делении клетки.
На основании строения клеточной стенки, а также ее химического состава все кокки, как и прочие бактерии, разделены на две большие группы — грамположительные и грамотрицательные. Известно, что у грамположительных бактерий клеточная стенка, как правило, толще, чем у грамотрицательных, хотя этот признак не стабилен. Например, стенки стрептококков становятся в 2—3 раза толще при добавлении к питательной среде хлорамфеникола, а клеточные стенки Staphylococcus aureus увеличиваются от 300 до 1000 А при выращивании на среде, содержащей 4,5% NaCl.
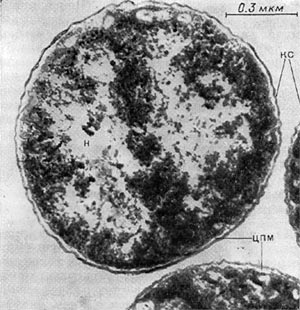
Рис. 112. Тонкое строение Neisseria catarrhalis. КС — клеточная стенка, ЦПМ — цитоплазматическая мембрана, Н — нуклеоид.
С помощью окраски уранилацетатом у грамположительных кокков проявляется довольно однородный плотный слой, иногда ограниченный более узкими электронно-плотными слоями с обеих сторон (рис. 2). Большую часть стенки этих организмов составляет муреин или пептидогликан, достигая у отдельных видов микрококков до 80— 90% от общей массы стенки. Это вещество придает стенке механическую прочность. Что касается других компонентов, то в клеточных стенках грамположительных кокков могут обнаруживаться различные тейхоевые кислоты, полисахариды и протеины. При изучении тонкого строения клеток различных кокков обнаружилось, что многие виды кокков, относимые ранее к роду Micrococcus (грамположительные кокки), по строению клеточной стенки оказались близки к грамотрица-тельным бактериям, и, следовательно, встает вопрос об исключении этих организмов из рода Micrococcus, а возможно, и из семейства Mic-rococcaceae. Так оказалось, что виды Micr. radiodurans, Micr. denitrificans, Micr. diversus, Micr. cryophilus имеют строение клеточной стенки, аналогичное таковому у грамотрицательных кокков рода Neisseria (рис. 112). Micrococcus radiodurans был описан как обычный грамположительный представитель рода Micrococcus, образующий тетрады и близкий к видам Micr. roseus и Micr. rubens tetragenus, отличающийся от них главным образом устойчивостью к радиации.
При изучении тонкого строения Micr. radiodurans было обнаружено, что клеточная стенка этого организма имеет сложное строение, характерное для грамотрицательных бактерий, и состоит из четырех слоев, каждый из которых имеет характерную тонкую структуру. Внешний мембранный волнистый слон напоминает таковой у сине-зеленых водорослей и участвует, по-видимому, в регулировании проницаемости. Часть этого слоя имеет хорошо выраженные участки гексагонально расположенных единиц. Мукопептидный слой пористый и имеет псевдогексагональное расположение пор. Определение химического состава клеточной стенки
Micr. radioclurans показало присутствие большого количества в ней липопротеинов и широкого набора аминокислота-характерного для грамотрицательных бактерий. Таким образом, и химический состав подтвердил принадлежность Micr. radiodurans к группе грамотрицательных кокков. Другой пример — исключение одного из видов кокков из семейства, к которому он был ранее отнесен, — Neisseria haemolysans. Строение клеточной стенки и способ деления этого организма оказались аналогичны таковым у грамположительных бактерий. Было предложено вид Neisseria haemolysans исключить из семейства грамотрицательных кокков Neis-seriaceae и отнести к семейству грамположительных организмов — Lactobacillaceae. В настоящее время на основании строения и химического состава клеточных стенок пересматривается таксономическое положение многих видов кокков. Наблюдается тенденция к сокращению числа видов микрококков. Так, кокки, называемые ранее Sarcina lutea, Micr. flavus, Micr. citreus, Micr. lysodeicticus, предлагается относить к одному виду — Micr. luteus.
Со строением клеточной стенки и цитоплазма-тической мембраны тесно связан и способ деления бактерий. Все грамположительные организмы делятся путем центрипетального врастания от краев к центру септ и последующего разделения клеток по этим перегородкам. До недавнего времени считали, что у грамотрицательных микроорганизмов деление происходит без образования перегородок путем постепенного впячивания всех слоев клеточной стенки внутрь с образованием перетяжки в центре клетки, которая становится все тоньше и тоньше и приводит к отделению клеток друг от друга. При определенных условиях фиксации клетки септы все же удалось обнаружить и у типичных грамотрицательных бактерий. Что касается кокков, то, к сожалению, в большинстве работ не описывается подробно способ деления. При просмотре фотографий срезов Micr. cryophilus, Micr. diversus, Neisseria sicca, Neisseria catarrhalis, Micr. denitrificans — организмов, имеющих строение клеточной стенки, типичное для грамотрицательных бактерий, видны перешнуровывающиеся при делении фигуры, а иногда одновременно и септы. Поскольку у истинных грамположительных бактерий не наблюдали перешнуровывания, нахождение такового у вышеописанных кокков служит, по-видимому, дополнительным подтверждением принадлежности этих культур к грамотрицательным бактериям.
Интересно исследование механизма клеточного деления у культуры грамвариабильного кокка. Этот кокк имеет типичное для грамотрицательных организмов строение клеточной стенки, но окраска по Граму была вариабиль-на. Химический же состав его клеточных стенок отличается от такового у грамотрицательных бактерий. Механизм клеточного деления заключается в образовании септы, состоящей из цитоплазматической мембраны и внутреннего слоя клеточной стенки. Внешняя мембрана при этом не втягивается вместе с внутренним слоем при образовании перегородки, а формируется заново при разделении клеток. Одновременно с образованием перегородки наблюдается и перешнуровывание. Исследователи, описавшие эту культуру, предложили такие грамвариабильные кокки, относимые ранее к микрококкам, поместить в отдельный род, промежуточный между истинными грамположительными и грамотрицательными бактериями.
В образовании перегородок перед делением возможны также различные варианты. Оказалось, что бактериальная клетка не всегда делится на две равные части с помощью одной септы; в ней могут одновременно закладываться несколько перегородок, делящих клетку на неравные части. Такой необычный способ деления был обнаружен у бластококка, метаносарцины, микококков, выделенных из литофильных лишайников. В результате беспорядочного деления клетки в разных плоскостях и благодаря тому, что клетки в течение длительного времени остаются соединенными вместе, образуются многоклеточные агрегаты неопределенных конфигураций. По-видимому, неравномерное деление клеток на несколько частей на одной из стадий развития довольно широко распространено среди кокков.
Таким образом, изучение тонкого строения клеток с помощью электронной микроскопии значительно расширило возможности использования морфологических показателей. Строение клеточной стенки кокков и способ их деления, по-видимому, будут широко использовать в будущем в качестве таксономических критериев.
Экология кокков и их роль в природе и жизнедеятельности человека
Как уже указывалось ранее, кокки представляют собой весьма гетерогенную группу микроорганизмов, имеющих полифилетическое происхождение. Некоторые грамотрицательные виды кокков близки по строению к сине-зеленым водорослям, часть грамположительных микрококков генетически связана, по мнению Н. А. Красильникова, с микококками и должна быть включена в класс Actinomycetes. Среди кокков есть паразиты, обитающие только в организме человека (менингококки и гонококки), приспособленные к паразитическому образу жизни и поэтому весьма трудно поддающиеся культивированию; есть сапрофитные кокки, обнаруживаемые в различных бродящих растительных субстратах (Leuconostoc pediococcus); есть строго анаэробные виды, обитающие лишь в болотах и стоячих водах (Methanosarcina); есть повсеместно распространенные в природе представители родов Micrococcus, Staphylococ-cus, Sarcina. В промышленности используется очень небольшое число видов кокков. К ним относятся Streptococcus lactis, используемый при приготовлении простокваши и кефира, Micrococcus casei и Micr. liquefaciens, применяемые в симбиозе с другими бактериями в созревании сыров.
Представители таких родов, как Pediococcus и Leuconostoc, наоборот, наносят вред при производстве пива и сахара, и с ними приходится вести борьбу. В качестве санитарно-показательных микроорганизмов, присутствующих в воздухе, считают наиболее подходящими стрептококки, постоянно обитающие в полости рта и носа людей. По концентрации этих бактерий судят о степени загрязненности воздушной среды. В воздухе необитаемых помещений стрептококки отсутствуют. При водоснабжении о степени загрязненности воды судят по количеству фекальных стрептококков, выделенных с испражнениями человека и животных.
Некоторые виды стафилококков являются источниками широко распространенных пищевых интоксикаций. Стафилококки часто обнаруживаются в изделиях из крема, в молочных, мясных и рыбных продуктах. Попадая в эти продукты из оболочки зева и носа людей, из воздуха, стафилококки, развиваясь там, выделяют энтеротоксины, не разрушающиеся при нагревании до 100 °С в течение 30 мин. Энтеротоксины стафилококков являются ядами и вызывают пищевые отравления.
Среди кокков существует много патогенных видов, вызывающих такие болезни, как менингит, крупозную пневмонию, гоноррею и пр. Некоторые виды стафилококков и стрептококков вызывают нагноение ран, септицемию, перитонит.
Таким образом, многие кокки наносят вред человеку, и с ними постоянно ведется борьба.
С другой стороны, широко распространенные в почве, воде, грязях, на поверхности живых растений и мертвых растительных остатках кокки принимают активное участие в круговороте веществ в природе. Недаром считается, что представители семейства Micrococcaceae играют роль «мусорщиков», разлагая органические остатки, осуществляя аммонификацию белковых веществ. При прямом микроскопировании почвы микробиологом С. Н. Виноградским было обнаружено большое количество кокков. Встречались как мелкие кокки (до 1 мкм в диаметре), образующие плотные скопления, заключенные в общую капсулу, так и более крупные кокки (до 2 мкм в диаметре) в менее плотных скоплениях. Эти кокковидные микроорганизмы располагались исключительно на гумусовых веществах (специфические органические вещества почвы). При использовании специальных, гуматных сред вырастали многочисленные колонии кокков. Эти кокковидные микроорганизмы, по мнению С. Н. Виноград-ского, и составляют автохтонную микрофлору почвы, т. е. микрофлору, разлагающую гумусовые вещества. Если к почве добавить легко усваиваемые органические питательные вещества, к колониям автохтонных микроорганизмов прибавятся другие формы (в основном бациллы), развивающиеся свободно в почвенном растворе и не связанные с частицами почвы и гумусовыми веществами.
Преобладание кокковых форм в почве, не получавшей в течение длительного промежутка времени легко поддающихся разложению свежих органических веществ, подтвердилось многими авторами.
При изучении вопросов адсорбции почвенных микроорганизмов оказалось, что многие представители родов Micrococcus и Sarcina обладают сильными адсорбционными свойствами. Электронно-микроскопическое изучение адсорбции микроорганизмов показало, что высокие адгезивные свойства этих организмов обусловлены наличием на их поверхности различных типов выростов. У сарцин были обнаружены перетрихиально расположенные выросты микрокапсулы, а у стафилококка — лофотрихиально расположенные шиповидные выросты. Таким образом, способность кокков адсорбироваться на поверхности почвенных частиц, отмеченная еще Виноградским, подтвердилась и получила объяснение в специальных опытах по адсорбции микроорганизмов. Следует сказать, однако, что при исследовании микрофлоры различных типов почв путем посева почвенных суспензий на различные питательные среды не обращалось внимания на количество кокков в почве, они учитывались в сумме с другими бактериальными колониями. Отсутствуют сведения о распространении различных родов и видов кокков в почвах, об их роли в почвообразовательном процессе. Тем не менее косвенные данные свидетельствуют о том, что кокки играют, по-видимому, немаловажную роль в почвообразовании. Кокковые формы бактерий, довольно редко обнаруживаемые в богатых почвах, встречаются, по данным некоторых авторов, в большом количестве на поверхности скал и в примитивных почвах. Было показано, что такой устойчивый минерал, как кварц, может разрушаться в результате подщелачивания среды в культуре Sarcina urea. Возможно, кокки наряду с микобактериями и другими неспороносными бактериями принимают участие в разрушении пород и участвуют таким образом в первичном почвообразовательном процессе. Большое количество кокковых форм микроорганизмов было обнаружено и в лишайниках, покрывающих горы Памира и,. Тянь-Шаня. В отдельных образцах лишайников кокки составили до 60 — 90% от общего числа выросших бактериальных колоний. Причем преобладали окрашенные формы кокков, что связано, по-видимому, с наличием в них пигментов, защищающих от действия повышенной ультрафиолетовой радиации.
Многие виды кокков были обнаружены и на поверхности высших растений среди прочей эпифитной микрофлоры. Причем оказалось, что кокки способны синтезировать гете-роауксин и витамины, стимулирующие рост растений. Подробное выяснение роли кокковых форм микроорганизмов в жизни почвы и растений — дело будущего.
Порядок миксобактерии (MYXOBACTER1ALES)
К этому порядку относят грамотрицательных бактерий, вегетативные клетки которых обладают большой гибкостью и способны к скользящему движению в слизи, продуцируемой ими в большом количестве. Клетки имеют палочковидную или веретенообразную форму с острыми концами. Большинство миксобактерий — аэробы, гетеротрофы.
Существенным отличием миксобактерий от истинных бактерий является их способность передвигаться за счет активного сгибания тела (жгутики отсутствуют). Такая особенность строения (эластичная клеточная стенка) свойственна простейшим животным организмам. Другой особенностью миксобактерий является образование плоских стелющихся по поверхности слизистых колоний, образующих выросты — псевдоплазмодий. Многие из них способны к образованию плодовых тел, напоминающих плодовые тела простейших. Эти тела, имеющие причудливую форму, но небольшие размеры (около 7 мм), являются разновидностью колониальной формы (рис. 113) и представляют собой стадию образования цист.
Систематическое положение миксобактерий до сих пор вызывает споры. Одни специалисты их считают родственными сине-зеленым водорослям, другие — простейшим.
Как бы ни обстояло дело с таксономией, но та группа микроорганизмов со скользящим движением, которая образует плодовые тела, в цикле своего развития претерпевает смену форм, сходную со сменой форм у простейших: стадии роения и образования цист. На стадии псевдоплазмодия миксобактерий размножаются путем поперечного деления, выделяя обильную слизь, в которой живут и перемещаются. Эта стадия продолжается 1—7 дней, после чего палочки начинают образовывать скопления, растущие над поверхностью субстрата. У некоторых видов палочки передвигаются в верхней части этих сложных структур. Там палочки укорачиваются, переходя в состояние покоящихся клеток. У миксококков они, например, становятся овальными, окрашиваются в темный цвет, приобретают толстые оболочки и становятся похожими на хламидоспоры (микроцисты) (рис. 114). При увлажнении покоящиеся вегетативные клетки прорастают и снова переходят к стадии псевдоплазмодия.
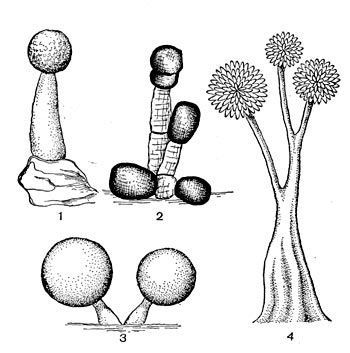
Рис. 113. Плодовые тела некоторых миксобактерий: I — Myxococcus stipitatus (высота колонии 0,1 мм); 2 — Podangium erectum (высота 50 мкм); з — Myxococcus fulvus (высота 150 мкм); 4 — Chondromyces sp. (высота 0,5 мм).
Истинные миксобактерий, образующие плодовые тела, представлены в природе следующими родами: миксококкус (Myxococcus), сорангиум (Sorangium), хондромицес (Chondromyces), хондрококкус (Chondrococcus), архангиум (Archangium), полиангиум (Polyangium), мелитангиум (Melittangium), подангиум (Podangium), стелангиум (Stelangium), синангиум (Synangium), ангиококкус (Angiococcus) (рис. 113).
По способности к скользящему движению, форме клеток с миксобактериями сходны два рода целлюлозоразлагающих бактерий — цитофага (Cytophaga) и спороцитофага (Sporocylophaga). Эти бактерии не образуют плодовых тел. Веретенообразные вегетативные клетки Sporocytophaga могут переходить в кокковидные микроцисты.
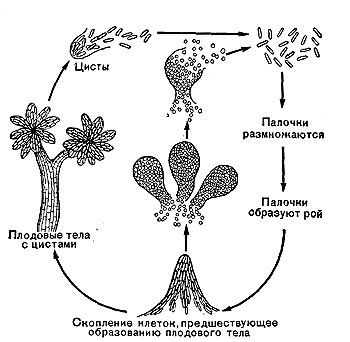
Рис. 114. Цикл развития миксобактерий из рода Chondromyces (по Шлегелю, 1972).
По ряду признаков подобны миксобактериям флексибактерии — обитатели пресной и морской воды. Клетки представителей рода Flexibacter имеют вид длинных гибких нитей толщиной менее 1 мкм, способных к скользящему движению.
Миксобактерии в природе играют очень важную роль. Многие представители этой группы активно разрушают мертвые растительные остатки (целлюлозу) и соединения, содержащиеся в наружных покровах насекомых и ракообразных (хитин), превращая их в вещества, пригодные для питания растений. Многие плодоносящие бактерии способны к внеклеточному паразитизму. Не проникая внутрь клеток жертв других бактерий и некоторых высших грибов, они вызывают их разрушение (лизис), используя освобождающиеся при этом вещества как пищу. Известны также случаи паразитизма флексибактерии на водорослях.
Порядок спирохеты (SPIROCHAETALES)
Спирохеты представляют группу бактерий, обладающих уникальной морфологией и способом движения. Клетки спирохет очень тонки (0,1—0,6 мкм), но их длина достигает 500 мкм. У клеток спирохет имеются три основные структуры: протоплазматичный цилиндр (собственно тело клетки), аксиальная (опорная) нить и трехслойная наружная оболочка. Клетки извиты, как у спирали, но обладают необычной гибкостью (рис. 115). Они способны изгибаться и сокращаться, перемещаясь винтообразно через полужидкие среды (рис. 116).
Спирохеты отличаются от других прокариотов по ряду признаков: ни один из представителей этой группы не ветвится, не образует слизистых масс, не имеет спор, включений, пигментов; размножаются клетки спирохет поперечным делением.
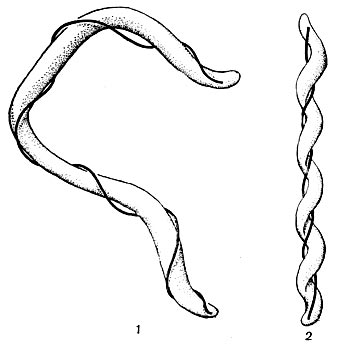
Рис. 115. Схема возникновения извитости клетки спирохеты за счет аксиальной нити (2). Аксиальная нить сокращена (1).
Порядок спирохет делится на два семейства: спирохеты (Spirochaetaceae), объединяющее гигантские организмы (длина клеток до 30— 500 мкм), и трепонемы (Treponemataceae), включающие более мелкие формы (4—16 мкм). Среди последних есть аэробные — лептоспира (Leptospira) — и анаэробные — трепонема (Тrеponema) и боррелия (Borrelia).
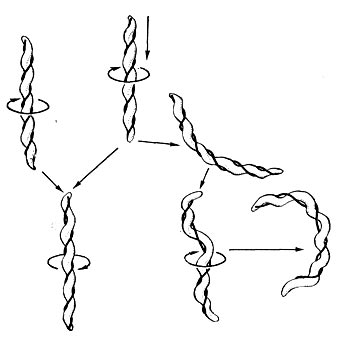
Рис. 116. Схема механизма движения спирохет
Многие представители спирохет живут как сапрофиты в пресных и соленых озерах, особенно в донных отложениях и гниющем иле. Среди этой группы бактерий многие виды являются возбудителями опасных заболеваний человека — сифилиса, инфекционной желтухи, возвратного тифа (боррелиозы). Они могут попадать в организм с водой или пищей.
Порядок микоплазмы (MYCOPLASMATALES)
Бактериальным клеткам свойственна определенная форма, придаваемая им жесткими (ригидными) клеточными стенками. Тем не менее широко распространена группа микроорганизмов, не имеющая клеточных стенок, вследствие чего они отличаются сильно выраженным плеоморфизмом (непостоянством морфологии клеток). Каждая колония состоит из клеток и частиц разной величины — кокков, нитей, розеток (рис. 117). Первоначально эта группа микроорганизмов была описана как «микроорганизмы группы PPLO» (от англ, pleuropneumonia-like-organisms) — возбудителей плевропневмонии крупного рогатого скота. Сходны с микоплазмами и L-формы бактерий, возникающие независимо от среды (спонтанно) либо под влиянием антибиотиков, аминокислот. Данные L-формы лабильные, т. е. на средах без этих веществ (пенициллина) вновь появляются нормальные клетки бактерий. Иногда L-формы становятся стабильными. В этом случае они неотличимы от микоплазм по морфологии, но обладают иным соотношением пар азотистых оснований по сравнению с истинными бактериями (% ГЦ - 23-39).
Порядок Mycoplasmatales имеет два семейства: микоплазмовые (Mycoplasmataceae) и ахо-леплазмовые (Acholeplasmataceae). Представители этих семейств различаются по потребности в стерине. Стеринзависимые организмы относят к семейству Mycoplasmataceae, не нуждающиеся в стерине — к семейству Acholeplasmataceae.
Недавно описан новый род термофильных кислотоустойчивых микоплазм — Thermomycoplasma acidofila. Этот организм выделен из каменного угля, подвергающегося саморазогреванию. Оптимальная температура для его развития равна 59 °С. Он растет в пределах 45—62°, но при 37° и 65° не растет. Оптимум рН — 1—2, культура развивается в интервале рН — 0,96—3,5, не растет при рН — 0,5 и очень слабо при рН — 4,0. Отсутствие клеточной стенки, плеоморфизм клеток, способность к почкованию, низкое содержание гуанина и цитозина (ГЦ) в ДНК, ингибирование роста антибиотиком новобиоцином, подавляющим микоплазмы, свидетельствует в пользу принадлежности этого организма к микоплазмам.
Размножение типичных представителей микоплазм (например, М. mycoides) происходит делением надвое путем распада нитей и колец на кокковидные клетки и процесса, сходного с почкованием (рис. 118). Образующиеся при этом мельчайшие клетки являются вообще мельчайшими живыми клетками, известными современной биологии, размером 0,125—0,150 мкм. Это значит, что микоплазменные минимальные клетки не только наименьшие среди организмов, имеющих клеточную структуру, но они меньше некоторых крупных вирусов. Эти клетки в 10 раз мельче средней бактерии, в 1000 раз мельче такого простейшего, как амеба. Микоплазменная клетка в 1 млрд. раз легче, чем простейшее (5-10 ~18 г). Если придерживаться линейных измерений, то следует отметить, что мельчайшая микоплазма по диаметру лишь в 1000 раз больше диаметра атома водорода (0,1 мкм больше в 1000 раз 1 ангстрема). Эти клетки соответствуют по размерам теоретически возможным наименьшим живым клеткам, учитывая толщину биологических мембран, комплекса ферментов, которые поддерживали бы 100 крайне необходимых энзи-матических реакций. В такой клетке содержится несколько больше 1200 макромолекул белка и около 12 000 000 атомов в сухом веществе.
Микоплазмы встречаются в разных источниках: в почве, сточных водах, загрязненных культурах тканей животных. Микоплазмы являются возбудителями заболеваний растений, домашней птицы, животных и человека (уретрит, плевропневмония и др.). Доказано, что непатогенные виды микоплазм способны существовать в почвах, паразитируя на других микроорганизмах (бактериях, низших грибах), способствуя существованию в природе сложных ассоциаций, описываемых в качестве самостоятельных организмов (Metallogenium, Gallionella и др., аккумулирующие железо и марганец бактерий). Есть сведения в пользу существования сапрофитных форм микоплазм.
Порядок риккетсии (RICKETTSIALES)
В порядке Rickettsiales, имеющем одно семейство риккетсовые (Rickettsiaceae), объединены типичные представители класса молликуты (Mollicutes), получившие название в честь американского ученого Риккетса, впервые описавшего возбудителей пятнистой лихорадки и сыпного тифа. Риккетсии (род Rickettsia) представляют собой мелкие грамотрицательные кокковидные или палочковидные клетки, имеющие 1—2 мкм в длину и 0,3—0,7 мкм в поперечнике. По тонкому строению они неотличимы от типичных грамотрицательных бактерий. Риккетсии способны запасать энергию в АТФ и обладают цитохромной системой. Один вид культивируется вне клетки на искусственной среде.
Представители рода Rickettsia являются возбудителями многих опасных болезней животных и человека (разные типы лихорадок, сыпной тиф, риккетсиозная оспа). Естественными очагами резервации и переносчиками риккет-сий являются членистоногие (клещи, пухоеды, блохи, вши). Представителями другого родственного рода коксиэлла (Goxiella) переносятся с пылью, молоком, сохраняя при этом жизнеспособность.
Порядок хламидии (CHLAMYDIALES)
Порядок Chlamydiales объединяет одно семейство хламидиевые (Chlamydiaceae) и один род хламидии (Ghlamydia). Хламидии являются типичными облигатными внутриклеточными энергетическими паразитами. В отличие от риккетсий они, будучи анаэробами, не обладают цитохромами, не способны генерировать АТФ (используют энергодающие соединения АТФ, НАД в клетках хозяина). Экстрацеллюлярное культивирование хламидии в отличие от риккетсий невозможно. Они отличаются также способом размножения и сложным циклом развития. Внутри цитоплазматической вакуоли клетки хозяина вначале развиваются крупные вегетативные клетки со слабыми, неригидными клеточными стенками. Эти клетки размножаются делением, но не являются инфекционными. Дочерние организмы формируются путем постепенной конденсации с образованием мелких инфекционных форм с ригидной клеточной стенкой. Они освобождаются после разрыва мембраны клетки хозяина. Обе указанные формы сильно различаются между собой по ряду признаков (в частности, по соотношению ДНК и РНК).









