Жизнь растений
Хемоавтотрофные бактерии
По типу питания все организмы делятся на автотрофов и гетеротрофов. Автотрофы, что в переводе с греческого означает «самопитающиеся», могут строить все соединения своих клеток из углекислоты и других неорганических веществ. Источником энергии для них служит либо свет (фотоавтотрофы), либо они ее получают при окислении минеральных соединений (хемо-автотрофы). Таким образом, ни для конструктивных, ни для энергетических процессов органические субстраты автотрофам не требуются.
Гетеротрофы также могут усваивать углекислоту. Однако им необходимы органические соединения как основные источники углерода, а в большинстве случаев и субстраты для получения энергии (хемоорганогетеротрофы). Такой тип питания реализуется у человека, животных и многих микроорганизмов. Лишь для некоторых бактерий, нуждающихся в готовых органических соединениях, источником энергии является свет (фотогетеротрофы).
Среди автотрофов наиболее широко распространены организмы, использующие лучистую энергию. Они представлены высшими растениями, водорослями и рядом бактерий, способных к фотосинтезу.
Хемоавтотрофы обнаружены только среди бактерий, т. е. только среди прокариотных организмов, причем количество их сравнительно невелико. Однако по своим физиолого-био-химическим свойствам, геохимической деятельности и значению для некоторых областей народного хозяйства эти микроорганизмы весьма интересны.
Существование хемоавтотрофов было открыто С.Н. Виноградским. Началом послужили его работы (1885—4889) по изучению нитчатых микроорганизмов, называемых серобактериями (Beggiatoa) и железобактериями (Leptothrix ochracea). В результате проведенных наблюдений Виноградский пришел к выводу, что жизнедеятельность указанных форм связана с окислением соответственно сероводорода и серы до серной кислоты или закисного железа в окисное и оба процесса имеют энергетическое значение.
Свою гипотезу Виноградский блестяще доказал, выделив (1890—-1892) чистые культуры нитрифицирующих бактерий (Nitrosomo-nas и Nitrobacter), которые росли на минеральных средах, окисляя аммонийный азот или нитриты и фиксируя при этом углекислоту.
В настоящее время хемоавтотрофов подразделяют на следующие группы, получившие свои названия соответственно природе окисляемых субстратов: 1. Нитрифицирующие бактерии. 2. Водородные бактерии. 3. Серобактерии и тионовые бактерии. 4. Железобактерии.
Кроме того, к хемоавтотрофам, видимо, принадлежит недавно обнаруженный Н. Н. Ляликовой-Медведевой микроорганизм Stibiobacter, окисляющий окислы трехвалентной сурьмы (Sb2O3) до пятивалентной (Sb205).
Таким образом, выявлены хемоавтотрофы, способные получать энергию в результате окисления минеральных соединений пяти элементов: Н, N, S, Fe и Sb.
Нитрифицирующие бактерии
Еще в 1870 г. Шлезинг и Мюнц (Schloesing, Muntz) доказали, что нитрификация имеет биологическую природу. Для этого они добавляли к сточным водам хлороформ. В результате окисление аммиака прекращалось. Однако специфические микроорганизмы, вызывающие этот процесс, были выделены лишь Виноградским. Им же было показано, что хемо-автотрофные нитрификаторы могут быть подразделены на бактерий, осуществляющих первую фазу этого процесса, а именно окисление аммония до азотистой кислоты (NH4+->NO2-), и бактерий второй фазы нитрификации,' переводящих азотистую кислоту в азотную (N02-->NO3-). И те и другие микроорганизмы являются грамотрицательными. Их относят к семейству Nitrobacteriaceae.
Бактерии первой фазы нитрификации представлены четырьмя родами: Nitrosomonas, Nitrosocystis, Nitrosolobus и Nitrosospira. Из них наиболее изучен вид Nitrosomonas euro-раеа, хотя получение чистых культур этих микроорганизмов, как и других нитрифицирующих хемоавтотрофов, до сих пор остается достаточно сложным. Клетки N. еurораеа обычно овальные (0,6—1,0 )< 0,9—2,0 мкм), размножаются бинарным делением. В процессе развития культур в жидкой среде наблюдаются подвижные формы, имеющие один или несколько жгутиков, и неподвижные зооглеи.
У Nitrosocystis oceanus клетки округлые, диаметром 1,8—2,2 мкм, но бывают и крупнее (до 10 мкм). Способны к движению благодаря наличию одного жгутика или пучка жгутиков. Образуют зооглеи и цисты.
Размеры Nitrosolobus multiformis составляют 1,0—1,5 X 1,0—2,5 мкм. Форма этих бактерий не совсем правильная, так как клетки разделены на отсеки, дольки (-lobus, отсюда и название Nitrosolobus), которые образуются в результате разрастания внутрь цитоплазматической мембраны.
У Nitrosospira briensis клетки палочковидные и извитые (0,8 —1,0 X 1,5—2,5 мкм), имеют от одного до шести жгутиков.
Среди бактерий второй фазы нитрификации различают три рода: Nitrobacter, Nitrospina и Nitrococcus.
Большая часть исследований проведена с разными штаммами Nitrobacter, многие из которых могут быть отнесены к Nitrobacter wino-gradskyi, хотя описаны и другие виды. Бактерии имеют преимущественно грушевидную форму клеток. Как показано Г. А. Заварзиным, размножение Nitrobacter происходит путем почкования, причем дочерняя клетка бывает обычно подвижна, так как снабжена одним латерально расположенным жгутиком. Отмечают также сходство Nitrobacter с почкующимися бактериями рода Hyphomicrobium по составу жирных кислот, входящих в липиды.
Данные относительно таких нитрифицирующих бактерий, как Nitrospina gracilis и Nitrococcus mobilis, пока весьма ограниченны. По имеющимся описаниям, клетки N. gracilis палочковидные (0,3—0,4 X 2,7—6,5 мкм), но обнаружены и сферические формы. Бактеррга неподвижны. Напротив, N. mobilis обладает подвижностью. Клетки его округлые, диаметром около 1,5 мкм, с одним-двумя жгутиками.
По строению клеток исследованные нитрифицирующие бактерии похожи на другие грамотрицательные микроорганизмы. У некоторых видов обнаружены развитые системы внутренних мембран, которые образуют стопку в центре клетки (Nitrosocystis oceanus), или располагаются по периферии параллельно цитоплазматической мембране (Nitrosomonas еигораеа), или образуют чашеподобную структуру из нескольких слоев (Nitrobacter winogradskyi). Видимо, с этими образованиями связаны ферменты, участвующие в окислении нитрификаторами специфических субстратов.
Нитрифицирующие бактерии растут на простых минеральных средах, содержащих окисляемый субстрат в виде аммония или нитритов и углекислоту. Источником азота в конструктивных процессах могут быть, кроме аммония, гидроксиламин и нитриты.
Показано также, что Nitrobacter и Nitrosomonas еигораеа восстанавливают нитриты с образованием аммония.
Такой микроорганизм, как Nitrosocystis oceanus, выделенный из Атлантического океана, относится к облигатным галофилам и растет на среде, содержащей морскую воду. Область значений рН, при которой наблюдается рост разных видов и штаммов нитрифицирующих бактерий, приходится на 6,0—8,6, а оптимальное значение рН чаще всего 7,0—7,5. Среди Nitrosomonas еигораеа известны штаммы, имеющие температурный оптимум при 26 или около 40 °С, и штаммы, довольно быстро растущие при 4°С.
Все известные нитрифицирующие бактерии являются облигатными аэробами. Кислород необходим им как для окисления аммония в азотистую кислоту:
NH4++3/2O2 ->N02-+ H20+2H+, дельта F = - 27,6.104d;w:,
так и для окисления азотистой кислоты в азотную:
NO2-+1/2О2 - NO3-, дельта F = -7,6*104дж.
Но весь процесс превращения аммония в нитраты происходит в несколько этапов с образованием соединений, где азот имеет разную степень окисленности.
Первым продуктом окисления аммония является гидроксиламин, который, возможно, образуется в результате непосредственного включения в NH4+ молекулярного кислорода:
NH4+ +1/2 O2 -> NH2OH+H+, дельта F = + 15,9*103дж.
Однако окончательно механизм окисления аммония до гидроксиламина не выяснен. Превращение гидроксиламина в нитрит:
NH2OH+O2 -> N02-+ H20+H+, дельта F = — 28,9 •104 Дж
как предполагают, идет через образование гипонитрита NOH, а также окись азота (N0). Что касается закиси азота (N20), обнаруживаемой при окислении Nitrosomonas europaea аммония и гидроксиламина, то большинство исследователей считает ее побочным продуктом, образующимся в основном в результате восстановления нитрита.
Исследование окисления Nitrobacter нитрита с использованием в опытах тяжелого изотопа кислорода (180) показало, что образующиеся нитраты содержат значительно больше 180, когда меченой является вода, а не молекулярный кислород. Поэтому предполагают, что сначала происходит образование комплекса N02~H2O, который далее окисляется до N0s~. При этом происходит передача электронов через промежуточные акцепторы на кислород. Весь процесс нитрификации можно представить в виде следующей схемы (рис. 137), отдельные этапы которой требуют, однако, уточнения.
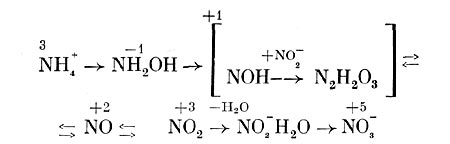
Рис. 131. Структурные формулы некоторых каротиноидов фототрофных бактерий.
Кроме первой реакции, а именно образования из аммония гидроксиламина, последующие стадии обеспечивают организмы энергией в виде аденозинтрифосфата (АТФ). Синтез АТФ сопряжен с функционированием окислительно-восстановительных систем, передающих электроны на кислород, подобно тому как это имеет место у гетеротрофных аэробных организмов. Но поскольку окисляемые нитрификаторами субстраты имеют высокие окислительно-восстановительные потенциалы, они не могут взаимодействовать с никотинамидадениндинуклеотида-ми (НАД или НАДФ, E = —0,320 В), как это бывает при окислении большинства органических соединений. Так, передача электронов в дыхательную цепь от гидроксиламина, видимо, происходит на уровне флавина:
NH2OH -> флавопротеид —> цит. b (убихинон?) —>—> цит. с -> цит. а —> - 02
Когда окисляется нитрит, то включение его электронов в цепь, вероятно, идет на уровне либо цитохрома типа с, либо цитохрома типа а. В связи с этой особенностью большое значение у нитрифицирующих бактерий имеет так называемый обратный, или обращенный, транспорт электронов, идущий с затратой энергии части АТФ или трансмембранного потенциала, образуемых при передаче электронов на кислород (рис. 138).
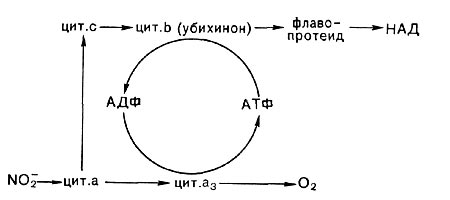
Рис. 132. Схема переноса электронов при фотосинтезе у растений: П, и П2 — пигменты фотоактивных центров; Z, и Z2 — первичные акцепторы электрона; Фд — ферредоксин; НАДФ — никотинамидадениндинуклеотидфосфат; АТФ — аденозинтрифосфат.
Таким образом происходит обеспечение хемо-автотрофных нитрифицирующих бактерий не только АТФ, но и НАДН, необходимых для усвоения углекислоты и для других конструктивных процессов.
Согласно расчетам эффективность использования свободной энергии Nitrobacter может составлять 6,0—50,0%, a Nitrosomonas — и больше.
Ассимиляция углекислоты происходит в основном в результате функционирования пенто-зофосфатного восстановительного цикла углерода, иначе называемого циклом Кальвина (см. рис. 134). Итог его выражают следующим уравнением:
6С02+18АТФ+12НАДН+12Н+ -> -> 6[СН20] + 18АДФ+18Фн+12НАД+6Н20,
где [СН2О] означает образующиеся органические вещества, имеющие уровень восстановлен-ности углеродов. Однако в действительности в результате ассимиляции углекислоты через цикл Кальвина и другие реакции, прежде всего путем карбоксилирования фосфоенолпирувата, образуются не только углеводы, но и все другие компоненты клеток — белки, нуклеиновые кислоты, липиды и т. д. Показано также, что Nitrococcus mobilis и Nitrobacter winogradskyi могут образовывать в качестве запасных продуктов поли-бета-оксибутират и гликогеноподобный полисахарид. Такое же соединение обнаружено в клетках Nitrosolobus multiformis. Кроме углеродсодержащих запасных веществ, нитрифицирующие бактерии способны накапливать полифосфаты, входящие в состав мета-хроматиновых гранул.
Еще в первых работах с нитрификатором Ви-ноградский отметил, что для их роста неблагоприятно присутствие в среде органических веществ, таких, как пептон, глюкоза, мочевина, глицерин и др. Отрицательное действие органических веществ на хемоавтотрофные нитрифицирующие бактерии неоднократно отмечалось и в дальнейшем. Сложилось даже мнение, что эти микроорганизмы вообще не способны использовать экзогенные органические соединения. Поэтому их стали называть «облигатными автотрофами». Однако в последнее время показано, что использовать некоторые органические соединения эти бактерии способны, но возможности их ограничены. Так, отмечено стимулирующее действие на рост Nitro-bacter в присутствии нитрита дрожжевого авто-лизата, пиридоксина, глутамата и серина, если они в низкой концентрации вносятся в среду. Показано также включение в белки и другие компоненты клеток Nitrobacter 14C из пирувата, альфа-кетоглутарата, глутамата и аспартата. Известно, кроме того, что Nitrobacter медленно, по окисляет формиат. Включение 14С из ацетата, пирувата, сукцината и некоторых аминокислот, преимущественно в белковую фракцию, обнаружено при добавлении этих субстратов к суспензиям клеток Nitrosomonas europaea. Ограниченная ассимиляция глюкозы, пирувата, глутамата и аланина установлена для Nitrosocystis oceanus. Есть данные об использовании 14С-ацетата Nitrosolobus multiformis.
Недавно установлено также, что некоторые штаммы Nitrobacter растут на среде с ацетатом и дрожжевым автолизатом не только в присутствии, но и в отсутствие нитрита, хотя и медленно. При наличии нитрита окисление ацетата подавляется, но включение его углерода в разные аминокислоты, белок и другие компоненты клеток увеличивается. Имеются, наконец, данные, что возможен рост Nitrosomonas и Nitrobacter на среде с глюкозой в диализируе-мых условиях, которые обеспечивают удаление продуктов ее метаболизма, оказывающих инги-биторное действие на данные микроорганизмы. На основании этого делается вывод о способности нитрифицирующих бактерий переключаться на гетеротрофный образ жизни. Однако для окончательных выводов необходимо большее число экспериментов. Важно прежде всего выяснить, как долго нитрифицирующие бактерии могут расти в гетеротрофных условиях при отсутствии специфических окисляемых субстратов.
Хемоавтотрофные нитрифицирующие бактерии имеют широкое распространение в природе и встречаются как в почве, так и в разных водоемах. Осуществляемые ими процессы могут происходить весьма в крупных масштабах и имеют существенное значение в круговороте азота в природе. Раньше считали, что деятельность нитрификаторов всегда способствует плодородию почвы, поскольку они переводят аммоний в нитраты, которые легко усваиваются растениями, а также повышают растворимость некоторых минералов. Сейчас, однако, взгляды на значение нитрификации несколько изменились. Во-первых, показано, что растения усваивают аммонийный азот и ионы аммония лучше удерживаются в почве, чем нитраты. Во-вторых, образование нитратов иногда приводит к нежелательному подкислению среды. В-третьих, нитраты могут восстанавливаться в результате денитрификации до N2, что приводит к обеднению почвы азотом.
Следует также отметить, что наряду с нитрифицирующими хемоавтотрофными бактериями известны гетеротрофные микроорганизмы, способные вести близкие процессы. К гетеротрофным нитрификаторам относятся некоторые грибы из рода Fusarmm и бактерии таких родов, как Alcaligenes, Corynebacterium, Achromoba-cter, Pseudomonas, Arthrobacter, Nocardia.
Показано, что Arthrobacter sp. окисляет в присутствии органических субстратов аммоний с образованием гидроксиламина и далее нитритов и нитратов. Кроме того, может образовываться гидроксамовая кислота. У ряда бактерий выявлена способность осуществлять нитрификацию органических азотсодержащих соединений: амидов, аминов, оксимов, гидро-ксаматов, нитросоединений и др. Пути их превращения представляют следующим образом:
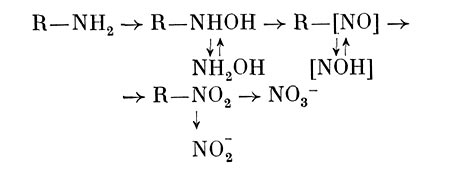
Размеры гетеротрофной нитрификации в некоторых случаях бывают довольно большие. Кроме того, при этом образуются некоторые продукты, обладающие токсичным, канцерогенным, мутагенным действием и соединения с хи-миотерапевтическим эффектом. Поэтому исследованию данного процесса и выяснению его значения для гетеротрофных микроорганизмов сейчас уделяют значительное внимание.
Водородные бактерии
Окислять молекулярный водород могут микроорганизмы, относящиеся к разным таксономическим группам. Среди них есть строгие анаэробы, факультативные анаэробы и обли-гатные аэробы. К анаэробным микроорганизмам, окисляющим Ш, принадлежат многие фототрофные и метанобразующие бактерии, некоторые представители десульфатирующих бактерий (Desulfovibrio desulfuricans) и клостридий (Clostridium aceticum, С. pasteurianum). К факультативным анаэробам и аэробам, обладающим таким свойством, относятся Escherichia coli, Paracoccus denitrif leans, Streptococcus faecalis и некоторые представители: Bacillus, Pseudomonas, Alcaligenes, Acetobacter, Azotobacter, Mycobacterium, Nocardia, Proteus, а также отдельные виды сине-зеленых и зеленых водорослей.
Однако далеко не все из перечисленных микроорганизмов растут за счет окисления молекулярного водорода в автотрофных условиях и сохраняют эту способность в течение длительного времени. Такая возможность имеется у фототрофных бактерий, но для этого им необходим источник энергии в виде света, а H2 служит только донором водорода (Н-донором) при фотоассимиляции углекислоты и в других конструктивных процессах. Для десульфатирующих бактерий молекулярный водород может являться энергетическим субстратом и обеспечивать восстановление углекислоты. Но наряду с углекислотой эти микроорганизмы требуют наличия готовых органических соединений. Следовательно, к автотрофам они не относятся. Аналогичным образом, видимо, используют молекулярный водород и метанобразующие бактерии.
Таким образом, микроорганизмов, использующих как источник энергии молекулярный водород и как единственный источник углекислоту, не так много, причем большинство растет в аэробных условиях и окисляет H2 с использованием 02. Такие микроорганизмы принято называть водородными бактериями или бактериями гремучего газа. Первые описания их были даны одновременно Лебедевым и Казерером в 1906 г., хотя биологическая природа процесса окисления молекулярного водорода в почве была установлена несколько раньше.
Вскоре после открытия автотрофных водородокисляющих микроорганизмов Орла Иенсен ввел для них название Hydrogenomonas, которое до последнего времени широко применяется. Однако как самостоятельная таксономическая единица этот род сейчас не принимается. На основании изучения свойств разных представителей гидрогеномонад, проведенного в последнее время под руководством Р. Стениера, предлагается часть из них отнести к роду Pseudomonas, а часть — к роду Alcaligenes. И те и другие водородокисляющие автотрофные бактерии представляют собой бесспоровые грамотрицательные палочки (0,3— 0,7 X 0,8—2,9 мкм). Но у бактерий, причисляемых к роду Pseudomonas, жгутики расположены полярно или субполярно, тогда как представители рода Alcaligenes относятся к пери-трихам, хотя количество жгутиков бывает весьма ограниченным (дегенеративно-перитрихиальный тип жгутикования).
К псевдомонадам, способным окислять молекулярный водород и расти в автотрофных условиях, принадлежат следующие виды: Pseudomonas flava, Ps. palleronii, Ps. facilis, Ps. saccha-rophila, Ps. ruhlandii. Водородные бактерии, включенные в род Alcaligenes, представлены A. europhus и A. paradoxus. Кроме этих микроорганизмов, известны и другие, растущие в автотрофных условиях за счет окисления молекулярного водорода. К ним принадлежат некоторые представители рода Nocardia (N. ораса) и другие грамположительные бактерии.
На минеральной среде в присутствии На и С02 растет, но медленно Paracoccus denitrificans, ранее известный под названием Micrococcus denitrificans. Этот грамотрицательный кокковидный микроорганизм интересен тем, что является факультативным анаэробом. В отсутствие воздуха он восстанавливает нитраты, нитриты и закись азота (N20) с образованием молекулярного азота, используя эти соединения как акцепторы электронов вместо О2. Однако в анаэробных условиях рост P. denitrificans происходит только в присутствии органических субстратов, хотя способность окислять молекулярный водород сохраняется.
Наконец, следует отметить, что молекулярный водород используют все микроорганизмы, способные окислять окись углерода. К таковым принадлежат недавно выделенные в лаборатории Г. А. Заварзина бактерии, названные Selliberia carboxydohydrogena. Это мелкие, подвижные, палочковидные, иногда изогнутые формы (0,3 X 0,6 —1,2 мкм), образующие розетки. Рост культур возможен в аэробных условиях в присутствии СО и СО2 или H2 и СО2.
Водородные бактерии растут на простых синтетических средах, содержащих в качестве источника азота соли аммония, нитраты, мочевину, некоторые аминокислоты, производные пуринов. Источником серы обычно служат сульфаты. Кроме солей фосфора, магния, калия, кальция, в среды добавляют микроэлементы, в число которых входят железо и никель. Для забуферивания среды вносят бикарбонат. Это помогает поддерживать значение рН на уровне (6,5—7,5), обеспечивающем достаточно быстрый рост культур. Оптимальная температура для роста разных видов и штаммов 28—35 °С. Известен лишь один представитель, описанный под названием Hydrogenomonas thermophi-les, для которого оптимальная температура около 50 °С.
Рост водородных бактерий в автотрофных условиях зависит от снабжения их углекислотой, водородом и кислородом. При составлении газовых смесей учитывают потребление бактериями отдельных компонентов, а также чувствительность разных представителей водородных бактерий к молекулярному кислороду. Обычно применяемые газовые смеси содержат 10% С02, 10—30% 02 и 60—80% Н2. Окисление молекулярного водорода кислородом воздуха отражает уравнение
H2+1/2O2 -> Н20, дельта F = -23,5*104Дж.
Однако, судя по потребляемым газам, общий результат процесса с учетом использования части водорода на восстановление углекислоты отвечает уравнению
6Н2+202+С08 -> [СН20.]+5Н20,
где (СН2О) — условное обозначение образующихся органических веществ.
Способность водородных бактерий и других микроорганизмов окислять молекулярный водород связана с наличием у них водородакти-вирующей системы, называемой гидрогеназой.
Окисление водорода с получением энергии в виде АТФ происходит через электрон-транспортную цепь, компонентами которой, по имеющимся данным, являются НАД, флаво-протеиды (ФП), цитохромы и, возможно, хи-ноны (X):
Н2 -> НАД -> ФП -> цит. b(Х?) -> цит. с -> цит. а+а3 -> 02
Однако у разных представителей водородных бактерий могут быть некоторые различия как в составе переносчиков электронов, так и в возможных путях переноса электронов от молекулярного водорода на кислород. Эффективность использования энергии может достигать 30%. Ассимиляция углекислоты водородными бактериями, как и у других хемоавтотрофов, происходит в основном при участии пентозофосфат-ного восстановительного цикла углерода (цикла Кальвина). Кроме того, происходит фиксация углекислоты на фосфоенолпирувате, который легко образуется из фосфоглицерата. Продукт реакции — щавелевоуксусная кислота — может включаться в цикл трикарбоновых кислот, обеспечивая образование других органических кислот, необходимых для синтеза аминокислот и порфириновых компонентов клеток.
Помимо образования из СОз основных соединений клеток, водородные бактерии могут синтезировать из нее большие количества (50% и более от сухой биомассы) поли-бета-оксибутирата, который является запасным продуктом. Образованию этого полимера способствует недостаток в среде азота, серы, фосфора, а также дефицит кислорода. Кроме поли-бета-оксибутирата, водородные бактерии накапливают полифосфаты.
В отличие от большинства нитрифицирующих бактерий, а также некоторых тионовых бактерий, все известные представители водородных бактерий хорошо растут на органических средах в отсутствие молекулярного водорода. При этом органические соединения служат для них энергетическими субстратами и основными источниками углерода. К числу органических соединений, используемых разными представителями водородных бактерий, относятся глюкоза, глюконат, ацетат, фумарат, сукцииат, лактат, бета-оксибутират, малат, пируват, аспартат, глутамат, аланин и фенилаланин.
В отношении использования других органических соединений, например Сахаров и спиртов, отдельные представители проявляют большие или меньшие различия.
Переключение водородных бактерий на гетеротрофный образ жизни, как правило, снижает их способность окислять молекулярный водород и фиксировать углекислоту. Первое обусловлено тем, что в присутствии органических соединений происходит подавление синтеза гидрогеназной системы, а второе связано с репрессией синтеза рибулезодифосфаткарбоксилазы, которая участвует в фиксации углекислоты через цикл Кальвина. Однако не все органические субстраты и не у всех водородных бактерий действуют на эти процессы одинаково.
Показано также, что молекулярный водород может оказывать существенное влияние на использование этими микроорганизмами некоторых органических субстратов. Ингибиция потребления водородными бактериями органических соединений в присутствии H2 получила название «водородного эффекта». Он проявляется, например, в отношении использования водородными бактериями фруктозы и обусловлен подавлением синтеза ферментов, участвующих в ее разложении. Кроме того, H2 может ингибировать активность некоторых ферментов.
Выше отмечалось, что водородные бактерии принимают активное участие в окислении водорода в природных условиях, где он может образовываться в результате деятельности определенных групп микроорганизмов. Культуры этих бактерий легко получить из почвы и многих водоемов, где идет разложение органических веществ. В настоящее время водородные бактерии привлекают к себе большое внимание в связи с такими практическими задачами, как получение дешевого пищевого и кормового белка, а также для регенерации атмосферы в замкнутых системах. Обе эти проблемы весьма актуальны, в частности в связи с развитием космических полетов. По сравнению с другими автотрофными микроорганизмами водородные бактерии характеризуются высокой скоростью роста и могут давать большие урожаи биомассы. Установлено также, что белки водородных бактерий полноценны по аминокислотному составу и усваиваются животными. Необходимые для развития водородных бактерий компоненты, а именно водород и кислород, получают в результате электролиза воды. Что касается источников углерода и азота, то они также легко доступны и могут быть продуктами отходов, которые подлежат удалению.
Помимо практических задач, изучение водородных бактерий представляет большой интерес для понимания особенностей автотрофов и регуляции их метаболизма.
Серобактерии и тионовые бактерии
Давно известно, что в сероводородных источниках и других водоемах, содержащих сероводород, как правило, встречаются в большом количестве неокрашенные микроорганизмы, в клетках которых обнаруживаются капли серы. В местах, где концентрация сероводорода сравнительно невелика (меньше 50 мг/л), такие микроорганизмы, получившие название бесцветных серобактерий, часто образуют массовые скопления в виде пленок, белых налетов и других обрастаний. С. Н. Виноградский (1887) доказал, что сера, откладываемая в клетках одного из типичных представителей серобактерий, а именно Beggiatoa, образуется из сероводорода и может окисляться этим микроорганизмом до серной кислоты. Для исследований им был применен оригинальный метод микрокультуры, который позволяет менять среду и проводить наблюдения за живым объектом в течение длительного времени. Результаты опытов с Beggiatoa, как уже указывалось выше, послужили основой для развития С. Н. Виноградским концепции о существовании микроорганизмов, способных к хемоавтотрофному образу жизни. Однако, как это ни странно, •такая возможность для большинства бесцветных серобактерий до сих пор не выяснена. Объясняется это тем, что большинство относимых к ним микроорганизмов не удалось еще культивировать в лабораторных условиях в виде чистых культур. Поэтому четких выводов относительно их физиологии и биохимических свойств сделать нельзя. Но обычно такие микроорганизмы рассматривают в числе бактерий, окисляющих восстановленные соединения серы.
В систематическом отношении бесцветные серобактерии, видимо, гетерогенная группа и далеко не все из описанных видов и даже родов можно считать твердо установленными. На основании особенностей морфологии Г. А. Заварзин (1972) подразделяет бесцветные серобактерии следующим образом:
1. Нитчатые формы.
К ним относятся микроорганизмы следующих родов: Beggiatoa, Thiospirillopsis, Thioploca, Thiothrix, Thiospirillum, Thiodendron. У представителей первых четырех родов клетки образуют трихомы. Наиболее известны из них Beggiatoa и Thiothrix. Основное отличие их состоит в том, что у Beggiatoa трихомы свободные PI способны к скользящему (ползающему) типу движения, а у Thiothrix трихомы прикрепляются к субстрату слизистым диском и клетки у основания более крупные. Образуют гормогонии. Описано шесть видов Beggiatoa (В. alba, В. arachnoidea, В. leptomitiformis, В. minima, В. gigantea, В. mirabilis) и семь видов Thiothrix (T. nivea, Т. tenuis, T. tenuissima, T. vouki, T. longiarti-sulata, T. anulata, T. marina), отдельные представители которых различаются по диаметру трихома. Так у разных видов Beggiatoa диаметр трихома варьирует от 1 до 55 мкм, а у Thiothrix — от 0,5 до 30 мкм, причем отдельные клетки могут быть весьма большими (до 33 мкм в длину).
У представителей рода Thioploca, которых известно четыре вида (Т. schmidlei, T. ingrica, Т. minima, T. mixta), имеется толстый слизистый чехол, в который могут быть заключены несколько свободных трихомов, способных к движению.
Thiospirillopsis также образует свободные трихомы со скользящим движением, но, в отличие от Beggiatoa, они изогнуты в виде спирали. Известен один вид — Т. floridana. У Thiospirillum pistiense клетки изогнуты и объединены в цепочки, причем в результате вращения отдельные нити могут переплетаться друг с другом. Сера обнаруживается на поверхности пучков нитей.
Своеобразной морфологией характеризуется микроорганизм, описанный Б. В. Перфильевым, под названием Thiodendron latens. Бактерии образуют очень тонкие нити, лишь на концах которых бывают видны вибрионоподобные клетки со жгутиками. По этим признакам они похожи на микроорганизмы, относимые к Ме-tallogenium.
2. Одноклеточные формы с крупными (около 10 мкм) клетками.
Таковы Achromatium, Thiovulum и Macromonas. Типовым видом Achromatium является A. oxaliferum. Клетки этого микроорганизма овальные и, кроме капель серы, часто содержат карбонат кальция. Размеры их составляют 10 —18 х 30—40 мкм. Делятся перетяжкой. При соприкосновении с субстратом наблюдается медленное кувыркающееся движение, хотя жгутиков нет.
У Thiovulum клетки округлые или овальные, 5 — 25 мкм в диаметре. Размножаются делением. Имеют жгутики: жгутикование перитрихиаль-ного типа. В клетках обнаружена развитая система мембран.
К роду Macromonas относят два вида — М. mobilis и М. bipunctata. Это цилиндрические, иногда изогнутые микроорганизмы размером 3—8 х 8—30 мкм. Более крупный первый вид. Кроме серы, иногда содержат карбонат кальция. Делятся перетяжкой. Похожи на Achromatium, но имеют по одному толстому жгутику.
3. Одноклеточные формы с более мелкими клетками.
Такие микроорганизмы объединяют в два рода — Thiospira и Thiobacterium.
Представители Thiospira изучены очень мало, хотя описано несколько видов (Т. winogradskyi, Т. bipunctata, T. elongata, T. undula). Все они имеют извитую форму клеток со жгутиками. Наиболее крупным видом является Т. winogradskyi. Размеры этой бактерии составляют 2,0—3,5 х 3,5—5,0 мкм.
Род Thiobacterium включает три вида — Т. bovista, T. cristallyferum, T. retiformans. Это неподвижные мелкие палочки, окруженные слизистыми капсулами; способны образовывать зооглеи. Отложение серы в клетках обнаружено только у Т. bovista.
По морфологии, характеру движения, способу размножения и строению клеток ряд представителей бесцветных серобактерий, как многоклеточные, так и одноклеточные (Beggiatoa, Thiothrix, Thiospirillopsis, Thioploca, Achromatium) проявляют большое сходство с сине-зелеными водорослями. Некоторые исследователи, в частности Прингсхейм (Pringsheim, 1963), рассматривают эти микроорганизмы как бесцветные их варианты. Аналогом Beggiatoa считают сине-зеленую водоросль Oscillato-ria, Thiothrix — Rivularia, Thiospirillopsis — Spirulina, a Achromatium похож на Synecho-coccus. Поскольку сине-зеленые водоросли сейчас причисляют к бактериям, то их сближение с бесцветными серобактериями становится все более обоснованным. Следует также отметить, что у некоторых сине-зеленых водорослей обнаружена способность откладывать в клетках серу, хотя один этот признак мало что дает для систематики микроорганизмов.
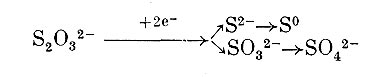
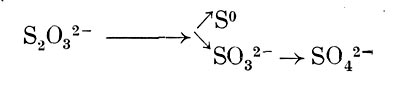
Микроорганизмы, относящиеся к бесцветным серобактериям, встречаются и в пресных и в соленых водоемах. Некоторые из них хорошо растут при низкой температуре, другие (Thios-pirillum pistiense) развиваются в термальных серных источниках при температуре более 50 °С. Бесцветные серобактерии аэробы. Подвижные формы обладают хемотаксисом и могут перемещаться в места с оптимальным содержанием кислорода и сероводорода. Еще С. Н. Виноградский отметил (1887 —1889), что бесцветные серобактерии могут расти в воде, содержащей очень небольшие количества органических веществ, и предполагал поэтому, что они способны усваивать углекислоту. Однако на минеральной среде, содержащей сероводород, удалось выращивать пока в виде чистых культур только Thiovulum majus и некоторые штаммы Beggiatoa. Другие представители микроорганизмов, определенные как Beggiatoa, оказались способными развиваться только на органических средах, содержащих сенной отвар, пептон, мясной экстракт, аминокислоты или ацетат. Некоторые проявили потребность в витамине В12. Добавление ацетата и других органических соединений также улучшало рост штаммов Beggiatoa, развивающихся на минеральных средах. При наличии ацетата в клетках отмечалось появление гранул поли-бета-оксибутирата. На основании изучения физиологии разных штаммов Beggiatoa Прингсхейм считает, что среди них есть автотрофы, окисляющие сероводород и фиксирующие С02, и есть представители, нуждающиеся в органических соединениях. Но и ряд гетеротрофных штаммов Beggiatoa в присутствии органических соединений окисляет сероводород, возможно, с получением энергии, т. е. они являются хемолитоге-теротрофами. Однако биология этих микроорганизмов, а еще в большей степени других бесцветных серобактерий исследована мало. Особенно заслуживает внимания вопрос о роли сероводорода в их метаболизме.
Наряду с бесцветными серобактериями известны типичные гетеротрофные микроорганизмы, участвующие в окислении сероводорода, молекулярной серы и тиосульфата. К числу таковых относятся представители Bacillus, Pseudomonas, Achromobacter, Sphaerotilus,, а также актиномицетов, плесневых грибов (Penicilliurn luteum, Aspergillus niger), дрожжей и Alternaria. Некоторые из них, в частности нитчатая многоклеточная бактерия Sphaerotilus natans, в присутствии сероводорода откладывает в клетках серу. Другие (Pseudomonas aeruginosa, Ps. fluorescens, Achromobacter stuzeri) способны окислять тиосульфат до тетратионата (NaaS406). Отмечено также образование политионатов и сульфата при воздействии смешанных культур гетеротрофных микроорганизмов на элементарную серу. Механизм окисления и биологическое значение этого процесса для гетеротрофов остаются не выясненными.
Сероводород и другие соединения серы окисляют большинство фототрофных бактерий, причем многие из них являются автотрофами. Для этих микроорганизмов восстановленные соединения серы служат Н-донорами при ассимиляции углекислоты и в других процессах, а источником энергии является свет. В отличие от этого большинство так называемых тионо-вых бактерий — типичные хемоавтотрофы, т. е. они используют восстановленные соединения серы не только как Н-доноры, но и в качестве источников энергии и способны расти на чисто минеральных средах, ассимилируя углекислоту. Такие бактерии были впервые выделены из воды Неаполитанского залива (Натансон, 1902) и получили название Thiobacillus (Бейеринк, 1904). К настоящему времени описано много видов автотрофных тиобацилл, выделенных из разных водоемов, почвы, а также из месторождений серы и разных металлов.
На основании некоторых, главным образом физиологических, особенностей (способность окислять различные соединения серы и другие неорганические субстраты, использовать органические соединения, расти в зависимости от значений рН среды, отношение к кислороду и др.) выделяют значительное число видов тиобацилл. Из них считаются наиболее твердо установленными следующие: Thiobacillus thioparus, Т. thiooxidans, Т. denitrificans, Т. thiocyano-xidans, Т. neapolitanus, T. intermedius, Т. novellus, T. ferrooxidanas. Все эти микроорганизмы растут на простых минеральных средах, куда часто вносят бикарбонат. Источником азота обычно служат соли аммония. Некоторые виды и штаммы способны ассимилировать как источники азота нитраты. Показана также способность отдельных представителей использовать мочевину и аминокислоты. Штаммы, выделенные из соленых водоемов, требуют для роста хлористого натрия, причем известны га-лофилы, способные расти в насыщенном растворе NaCl. Оптимальная температура для роста большинства выделенных микроорганизмов рода Thiobacillus около 30 °С. Однако в природных условиях они встречаются в термальных источниках при температуре до 55 °С. Недавно выделена чистая культура Thiobacillus sp. с оптимумом для роста при 50 °С.
По отношению к кислотности среды тиоба-циллы подразделяются на организмы, хорошо растущие при нейтральной или даже щелочной реакции, и виды, являющиеся ацидофильными, т. е. развивающиеся в кислой среде и выдерживающие очень низкое значение рН.
К первой группе относятся такие виды, как: Т. thioparus, T. denitrificans, T. novellus, Т. thiocyanoxidans, T. neapolitanus. Для этих микроорганизмов оптимальное значение рН приходится на область 6,0—9,0, а зона значений рН, при которых возможен их рост,— от 3,0—6,0 до 10,0—11,0, причем для разных видов и штаммов оптимальные значения рН и область активной кислотности, в которой наблюдается их рост, могут заметно различаться.
Ко второй группе принадлежат Т. thiooxidans, Т. ferroxidans, T. intermedius. Для этих микроорганизмов оптимальное значение рН 2,0—4,0, а рост возможен при рН от 0,5 — 2,0 до 5,0—7,0. Наиболее ацидофильными организмами являются два первых вида. Обе эти бактерии растут при значениях рН не более 5,0. В то же время показано, что Т. thiooxidans сохраняет жизнеспособность при значении рН, близком к 0, что соответствует 1,0 п. раствору серной кислоты. Это, пожалуй, самый ацидофильный микроорганизм, который известен исследователям.
Большинство тионовых бактерий растет только в присутствии кислорода, хотя рост некоторых представителей возможен при низком его содержании. Но известны и факультативные анаэробы. К ним относится Т. denitrificans. В аэробных условиях эти бактерии ведут окислительные процессы с участием молекулярного кислорода, в анаэробных переключаются на денитрификацию и восстанавливают нитраты до молекулярного азота. Интересно отметить, что ассимилировать нитраты как источники азота Т. denitrificans, подобно Paracoccus denitrificans, не может и требует для роста в качестве источника азота аммония.
Тионовые бактерии способны окислять такие соединения серы, как сероводород, сульфиды, сульфит, тиосульфат, тетратионат, тиоцианат (роданид), дитионит, а также молекулярную серу, с образованием при полном их окислении сульфатов. Однако способности отдельных видов не вполне одинаковы. Кроме того, не всегда легко установить, какие именно соединения серы окисляются биологическим путем, так как многие из них неустойчивы при низком значении рН и могут также окисляться кислородом воздуха.
Все виды, растущие при нейтральной и щелочной реакции среды, как правило, окисляют сероводород, серу и тиосульфат. Характерным признаком Т. thiocyanoxidans является способность окислять роданид. На этом основании его выделяют в отдельный вид, так как по другим признакам этот микроорганизм похож на Т. thioparus. Такую ацидофильную бактерию, как Т. thiooxidans, культивируют обычно на среде, содержащей молекулярную серу. Вопрос о способности данного вида окислять сероводород и другие соединения серы окончательно не решен, так как в кислых условиях эти соединения неустойчивы. В отношении Т. fer-roxidans есть данные, что эти бактерии могут окислять как молекулярную серу, так и различные ее соединения, а именно: сероводород, тиосульфат, дитионит, тетрасульфат, сульфит. Кроме того, Т. ferroxidans активно участвует в окислении сульфидов тяжелых металлов, которые нерастворимы в воде. К ним относятся такие минералы, как пирит (FeS2), халькопирит (CuFeSz), антимонит (SbS2), халькозин (Сu2S), кавеллин (CuS), пирротин (FeS), реальгар (AsS), виоларит (Ni2FeS4) и др. Остальные тио-новые бактерии или такой возможностью не обладают, или она выражена слабо.
Отличительным свойством Т. ferroxidans является также способность окислять закисное железо в окисное. На этом основании данные бактерии могут рассматриваться как железобактерии, хотя относятся к роду Thiobacillus.
Как уже отмечалось выше, конечным продуктом окисления тионовыми бактериями молекулярной серы и различных ее соединений является сульфат. Если процесс идет таким образом, т. е. происходит полное окисление исходного субстрата, то результаты его отражают следующие уравнения. При окислении сероводорода:
H2S+1/202->Н2О+S0 ; дельта F = -17,2*104 дж.
При окислении серы и тиосульфата в аэробных условиях:
S0+1/2О2+Н20 -> Н2S04, делта F = - 49,8104 дж,
S2032- + 202 + H20 -> 2S042- + 2H+,
дельта F = — 88,6*10 4 дж.
При окислении серы и тиосульфата Т. denitri-ficans в анаэробных условиях за счет использования нитратов:
5S+6KN03+4NaHCO3 -> 2Na2S04+3K2S04+2C02+3N2
5Na2S203+8KN03+2NaHC02 -> 6Na2S04+4K2S04+4N,+C02+H20,
дельта F = — 75,2*104 дж.
При окислении Т. thiocyanoxidans роданида:
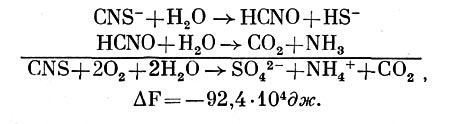
Однако нередко окисление идет не до конца, и в среде обнаруживаются различные не полностью окисленные продукты. Так при окислении сероводорода иногда появляется молекулярная сера, обнаружены также тиосульфат и политионаты. При окислении бактериями молекулярной серы констатировали появление тиосульфата и политионатов. Окисление тиосульфата также часто сопровождается образованием политионатов (тритионата, тетратионата, пентатионата) и элементарной серы. К числу не полностью окисленных продуктов относится и сульфит. Но не все из этих соединений могут являться результатом ферментативных процессов и действительно относятся к промежуточным продуктам окисления бактериями исходного субстрата. Некоторые из них образуются, видимо, чисто химическим путем или в результате побочных биологических реакций. Поэтому выяснение путей окисления микроорганизмами различных соединений серы весьма сложно, и далеко не все реакции до сих пор выяснено.
Очень мало еще данных о природе первого этапа превращения сульфида и не выяснено до конца, является сера прямым или побочным продуктом его окисления.
Весьма сложен вопрос об использовании бактериями элементарной серы, причем он имеет два аспекта: каким образом микроорганизмы воздействуют на это нерастворимое в воде вещество и как происходит сам процесс окисления.
В отношении механизма воздействия тиобацилл на серу существуют две точки зрения.
1. Для окисления бактериями серы необходим непосредственный контакт ее с клетками.
2. Сера используется бактериями после предварительного растворения в веществах липид-ной природы, выделяемых ими в среду.
При росте Т. thiooxidans на среде с молекулярной серой в среде обнаруживаются фосфолипиды. По одним данным — это фосфатидилино-зит, по другим — несколько иные соединения (фосфатидил-N-метилэтанол, фосфатидилглице-рин, дифосфатидилглицерин), причем их накопление совпадает с фазой активного роста культур. Тем не менее считать доказанным второе предположение нельзя. Вполне вероятно, что для окисления серы бактериями важен и контакт ее с клетками, и выделение ими определенных веществ, которые «смачивают» серу.
Что касается пути окисления серы, то данные также довольно разноречивы. Наиболее вероятной считается следующая схема, которая приемлема также для окисления сероводорода:
Предполагается, что X либо производное глутатиона, с которым реагирует сероводород или сера, либо тиол, связанный с мембранами клеток. Образование тиосульфата рассматривается как неферментативный процесс, который может идти без участия бактерий.
Большое число исследований посвящено изучению окисления тиосульфата. Данные опытов, проведенных с целыми клетками и бесклеточными препаратами разных видов тиобацилл, позволяют считать, что начальный этап превращения тиосульфата может быть связан либо с его восстановлением под действием редуктазы с образованием сероводорода и сульфита:
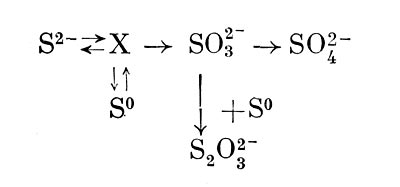
либо с расщеплением до элементарной серы и сульфита:
либо, наконец, с окислением до тетратионата и затем превращением в тритионат и сульфит:
Предполагают, однако, что последний путь превращения тиосульфата не является основным. Что касается расщепления тиосульфата с образованием сульфита, то такую реакцию может осуществлять родоназа, связывающая серу в виде тиоцианата:
S2032- + CN- -> S032- + CNS-
Она широко распространена не только у тионовых и других бактерий, но также у животных. Однако участвует ли этот фермент в метаболизме тиосульфата тионовыми бактериями, окончательно не установлено.
Значительно более исследован путь окисления сульфита. Работами, проведенными в лаборатории Пека с Т. thioparus, показано, что сульфит взаимодействует с аденозинмонофосфатом (АМФ), что приводит к образованию соединения, называемого аденилилсульфатом или аденозинфосфосульфатом (АФС). На следующем этапе происходит реакция между АФС и неорганическим фосфатом (Фн) с образованием аде-нознндифосфата (АДФ) и освобождением свободного сульфата:
28032-+2АМФ -> 2АФС+2е 2АФС+2Фн -> 2АДФ+2 S042-
В результате действия фермента аденилаткиназы две молекулы АДФ могут превращаться в АТФ и снова давать АМФ:
2АДФ -> АТФ + АМФ
Таким образом, данный путь окисления сульфита связан с получением энергии (АТФ) в результате так называемого субстратного фосфорилирования. В то же время процесс окисления сульфита может сопровождаться передачей электронов в дыхательную цепь, функционирование которой сопряжено с синтезом АТФ.
Для ряда тионовых бактерий, в том числе Т. thioparus, показано, что окисление сульфита возможно и без образования АФС, в результате действия сульфитокисляющего фермента, который обеспечивает передачу электронов в дыхательную цепь на уровне цитохромов:
S032-+2цит. Fe3+ + H20 -> S042- + 2цит. c Fe2+ + 2H+
Не исключено, что у одного и того же организма могут функционировать разные пути окисления сульфита и других соединений серы, и значение того или иного зависит от условий среды и других факторов. На основании имеющихся к настоящему времени данных окисление тионовымп бактериями разных соединений серы можно представить следующей обобщенной схемой (рис. 139).
Что касается компонентов электрон-транспортных систем тионовых бактерий, то, по всем данным, в состав их у разных видов всегда входят цитохромы типа с. Обнаружены также цитохромы типа Ъ и, видимо, его вариант, называемый цитохромом о, а у некоторых представителей — цитохромы а и d. Кроме того, в электрон-транспортную систему входят, видимо, флавопротеиды и убихиноны. Но дыхательная цепь тионовых бактерий, обеспечивающая передачу электронов на кислород, как и у нитрифицирующих бактерий, сравнительно короткая, так как окисляемые субстраты имеют довольно высокий окислительно-восстановительный потенциал. Поэтому для данных микроорганизмов важное значение имеет энергозависимый перенос электрона против термодинамического градиента (обратный перенос электрона). Он обеспечивает образование восстановленного НАД, необходимого для ассимиляции углекислоты и других конструктивных процессов. Следует также отметить, что компоненты электрон-транспортных систем и пути переноса электронов не только могут иметь определенные различия у разных представителей тионовых бактерий, но и зависеть от характера окисляемого субстрата. Поэтому обобщенная схема (рис. 140) весьма условна.
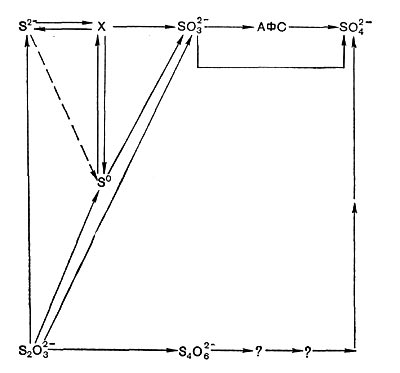
Рис. 139. Пути окисления соединений серы тоновыми бактериями.
По расчетам разных авторов, эффективность использования тионовыми бактериями свободной энергии составляет от 2 до 37%. Как и другие хемоавтотрофы, тионовые бактерии ассимилируют углекислоту в основном через цикл Кальвина (см. главу «Фототрофные бактерии»). Но они обладают также способностью осуществлять другие реакции карбоксилирования, которые имеют важное значение для образования некоторых метаболитов.
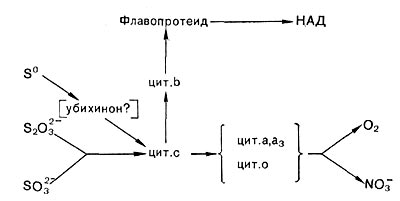
Рис. 140. Пути переноса электронов у тионовых бактерий при окислении разных соединений серы.
Разнообразно отношение тионовых бактерий к органическим соединениям. Ряд представителей этих микроорганизмов, а именно: Т. thioparus, Т. thiooxidans, T. thiocyanoxidans, Т. denitrifleans, T. neapolitanus, способны ассимилировать некоторые органические соединения, в частности ацетат, пируват, отдельные аминокислоты, включая их углерод в белки и другие компоненты клеток, но в ограниченной степени. Так, например, углерод ацетата в клетках Т. thioparus может составлять около 9%, сукцината — до 11%, а пирувата — около 2,5%. В отсутствие неорганических восстановленных соединений серы эти микроорганизмы не растут или рост их наблюдается в специфических условиях и медленный. Так, есть данные, что можно получить рост культур Т. thioparus, Т. thiooxidans, T. denitrificans, T. neapolitanus на среде с глюкозой в диализируемых культурах. Объясняют это тем, что необходимо постоянно удалять из среды продукты метаболизма глюкозы в виде кетокислот (пирувата и, возможно, других), которые ингибируют рост тиобацилл.
Такой организм, как Т. intermedius, не растет на средах с глюкозой или глутаматом без дрожжевого автолизата, но добавление этих соединений или дрожжевого автолизата к минеральной среде с тиосульфатом заметно ускоряет рост культур и увеличивает биомассу. При этом бактерии большую часть углерода клеток строят из органических субстратов. Фиксация углекислоты резко снижается из-за подавления синтеза рибулезодифосфаткарбоксилазы — ключевого фермента цикла Кальвина. Снижается также скорость окисления тиосульфата.
Есть и такие представители тиобацилл, которые легко переключаются с автотрофного на гетеротрофный образ жизни и рост их на органических средах не зависит от наличия восстановленных соединений серы. К ним принадлежат Т. novellus и другие близкие организмы, которые способны хорошо расти на средах с разными сахарами, спиртами, органическими кислотами и аминокислотами. При этом некоторые органические соединения (глюкоза, лак-тат, глицерин, пируват) полностью подавляют способность Т. novellus окислять тиосульфат, тогда ка-к другие (сукцинат, цитрат, аланин, глутамат) почти не оказывают действия. Показано также, что в результате роста на среде с глутаматом активность рибулезодифосфаткарбоксилазы у Т. novellus составляет менее 1% от активности в клетках, выросших на минеральной среде.
Таким образом, возможность автотрофной фиксации углекислоты почти утрачивается, хотя способность бактерий окислять тиосульфат сохраняется.
Описаны, наконец, тионовые бактерии, которые вообще растут только на органических средах. Однако их рост в таких условиях ускоряется в присутствии тиосульфата, который они окисляют до сульфата, видимо, с получением энергии, т. е. ведут себя как хемолито-гетеротрофы. К таким организмам принадлежит Т. permetabolis. К числу тионовых бактерий иногда относят и Т. trautweinii, который также проявляет способность окислять тиосульфат, но растет только на органических средах. Однако полагают, что для данных бактерий, как и для некоторых других гетеротро-фов, окисление тиосульфата не имеет существенного биологического значения, а является побочной реакцией.
Таким образом, среди тионовых бактерий есть организмы с разными потенциями к автотрофному и гетеротрофному образу жизни. Причина, почему Т. permetabolis не растет в автотрофных условиях, видимо, состоит в том, что эти бактерии не образуют рибулезодифосфаткарбоксилазу и не могут фиксировать углекислоту через цикл Кальвина. У Т. intermedius, которая хотя и растет на минеральной среде, но медленно, активность этого фермента по сравнению с другими тионовыми бактериями, растущими в автотрофных условиях, слабая. Следовательно, ограниченные способности Т. intermedius к росту в автотрофных условиях и отсутствие таковой у Т. permetabolis связаны с возможностями этих бактерий использовать углекислоту для образования разных компонентов клеток.
С другой стороны, исследователей давно интересует вопрос, почему некоторые тионовые бактерии и другие автотрофные микроорганизмы (нитрификаторы, фототрофы) проявляют ограниченные возможности использовать в своем метаболизме экзогенные органические соединения и нуждаются, как правило, в специфическом источнике энергии. Причины этого выяснены не до конца. Существуют разные предположения.
Некоторые исследователи считают, что исходные органические субстраты или продукты их метаболизма могут оказывать токсическое действие на определенные виды автотрофов. Но если удалять такие метаболиты, то можно получить рост культур и в гетеротрофных условиях.
Однако экспериментальные данные, подтверждающие эту гипотезу, пока ограничены и нуждаются в дальнейшей проверке.
Второе предположение заключается в том, что для проникновения органических веществ в клетки автотрофов требуется затрата энергии, источником которой служит либо свет (для фотоавтотрофов), либо неорганические окисляемые субстраты (для хемоавтотрофов). Кроме того, облигатная зависимость некоторых автотрофов от восстановленных соединений серы или азота может быть связана с тем, что они используются в конструктивных процессах. Например, известно, что Т. neapolitanus ассимилирует серу только в восстановленной форме, так как не обладает способностью к ассимиляционной сульфатредукции, а Т. denitrificans нуждается в аммонии не только как в источнике энергии, но и как в источнике азота.
Есть также ряд данных, позволяющих предполагать, что ограниченные возможности некоторых автотрофов использовать органические соединения обусловлены определенными нарушениями ферментных систем, участвующих в их метаболизме. Известно, что многие автотрофные микроорганизмы, которые плохо или совсем не растут на органических средах, не проявляют активности а-кетоглутаратдегидрогеназы. Поэтому полный цикл трикарбоновых кислот, через который происходит окисление ацетата и других органических кислот, у них действовать не может. У некоторых автотрофов (например, у Т. neapolitanus) не обнаружена также изиоцитрат-лиаза — один из специфических ферментов глиоксилатного цикла. Все это ограничивает использование органических соединений и в конструктивных процессах.
Использование органических соединений может тормозиться низкой активностью ряда ферментов. Например, известно, что у Т. denitrificans очень слабая активность малатдегидрогеназы и сукцинатдегидрогеназы. Возможны дефекты и в других ферментных системах. Наиболее вероятным считают, что ограниченные способности некоторых автотрофов использовать органические соединения обусловлены рядом их особенностей, а не каким-нибудь одним свойством. Однако вопрос этот требует дальнейшего детального изучения. На основании имеющихся сейчас данных можно сказать, что все исследованные автотрофы в той или иной степени проявляют способность использовать экзогенные органические соединения, причем в первую очередь как дополнительные источники углерода. Поэтому термин «облигатные автотрофы» по существу не правилен. В действительности к облигатным автотрофам относят организмы, нуждающиеся в свете или неорганических субстратах как источниках энергии и в углекислоте как основном источнике углерода, но способные в ограниченной степени ассимилировать органические соединения. В отличие от этого, так называемые факультативные автотрофы легко переключаются на использование органических соединений в качестве источников энергии и основных источников углерода.
Кроме рассмотренных выше тионовых бактерий, известно несколько других хемоавтотрофов, окисляющих соединения серы.
Так из морского ила недавно выделены подвижные спириллы, клетки которых обычно небольшие (0,2—0,3 х 1,0—4,0 мкм), но могут достигать 20—30 мкм в длину. Этот микроорганизм, названный Thiomicrospira pelophila, по своей физиологии очень похож на Thiobacillus thioparus. Рост происходит в аэробных условиях на минеральных средах, содержащих сульфид, серу, тиосульфат или тетратионат. Оптимальное значение рН 6,5—7,5; температуры 28-30 °С.
Еще раньше М. А. Егоровой и З.П. Дерюгиной были описаны спорообразующие бактерии Thiobacillus thermophila из термального источника, которые росли на минеральной среде с сульфидом или тиосульфатом при 55—60 °С.
Выделено также два других автотрофных термофильных микроорганизма. Оба они отнесены к новому роду — Sulfolobus — дольчатых серных бактерий. Один из них, названный Sulfolobus acidocaldaris, растет как в автотрофных условиях, окисляя серу, так и на органических средах при значениях рН от 0,9 до 5,8 (оптимум 2,0—3,0). Рост возможен при 55—85 °С. Оптимальная температура 70—75 °С. Встречается в горячих источниках и окружающей почве. Второй представитель этого рода также выделен из горячего источника с кислой реакцией воды. Оптимальное рН для его роста около 2,0. Максимальная температура, при которой возможен рост, 75 °С, минимальная 45 °С. Рост наблюдается на минеральной среде, содержащей молекулярную серу или двухвалентное железо.
Микроорганизмы, окисляющие неорганические соединения серы, играют весьма существенную роль в процессах их превращения в природе (рис. 5). Особенно важное значение в круговороте серы, видимо, имеют тионовые бактерии, широко распространенные в различных водоемах, почве и в разрушающихся горных породах.
В результате деятельности этих микроорганизмов, а также бесцветных и окрашенных серобактерий происходит окисление значительной части сероводорода и других соединений серы в водоемах. Причем в некоторых случаях имеет место отложение значительного количества серы. Активное окисление серы тионовыми бактериями в почве нашло практическое применение. Для уменьшения щелочности почвы вносят элементарную серу, которая быстро окисляется этими микроорганизмами с образованием серной кислоты.
Так называемое сернокислое выветривание горных пород также обусловлено деятельностью тионовых бактерий и является результатом образования ими серной кислоты. Такова же нередко причина порчи некоторых каменных и металлических сооружений.
Есть основания считать, что наряду с десуль-фатирующими бактериями, которые восстанавливают сульфаты до сероводорода, тионовые бактерии участвовали в какой-то степени в образовании некоторых месторождений самородной серы, окисляя сульфиды до молекулярной серы. Но эти же микроорганизмы могут являться основной причиной быстрого разрушения серных руд, проводя окисление до конца, т. е. до серной кислоты. Такие процессы, как показано С. И. Кузнецовым и его сотрудниками, нередко имеют место при разработке серных месторождений, когда создаются аэробные условия.
Таким образом, деятельность микроорганизмов, окисляющих серу и различные ее соединения, по своим результатам достаточно разнообразна.
Железобактерии
Известно значительное число микроорганизмов, прямо или косвенно участвующих в окислении железа. Некоторые из них были открыты еще в середине прошлого века, но до сих пор в виде чистых культур удалось получить лишь немногие. Поэтому сведения о биологии большинства таких форм весьма ограничены и основаны на изучении либо только природного материала, либо накопительных культур.
На основании имеющихся данных можно, однако, заключить, что многие из них являются гетеротрофами. К числу таковых принадлежат микроорганизмы, окисляющие комплексные органические соединения железа. В результате этого железо в виде гидрата окиси откладывается на поверхности клеток. Такие микроорганизмы встречаются и в водоемах, и в почве. К числу водных форм относятся Siderocapsa, Blastocaulis, Neumanniella, Ochrobium и некоторые другие. В почве в разложении гума-тов железа, видимо, участвуют почкующиеся бактерии родов Hyphomicrobium, Pasteuria и Seliberia stellata. Описаны также разнообразные по морфологии микроорганизмы, которые, судя по ряду данных, могут окислять неорганические соединения железа в болотах, ручьях, железистых источниках, дренажных трубах, в озерах и других водоемах с образованием охристых осадков. Некоторые встречаются и в почве. Именно такие формы были названы железобактериями. К ним принадлежат представители нитчатых бактерий (Leptothrix, Toxo-thrix, Crenothrix), а также Gallionella, Sidero-coccus, Methallogenium. Наиболее широко распространены нитчатые бактерии, называемые Leptothrix ochracea. По описаниям палочковидные клетки этой бактерии собраны в цепочки и окружены влагалищем, где откладывается гидрат окиси железа. Благодаря наличию жгутиков клетки способны к движению и могут покидать влагалище. Обычно встречается в ручьях, у выхода железистых источников на болотах, образуя скопления в виде ржавых пятен.
Хотя еще С. Н. Виноградский (1888) показал, что L. ochracea превращает закисное железо в окисное, способность этих бактерий к авто-трофному образу жизни не доказана и все данные о биологии основаны, по существу, на исследовании природного материала. Окончательно не решено даже, является Leptothrix самостоятельным родом или это представители Sphaerotilus, гетеротрофной нитчатой бактерии, которая способна откладывать вокруг клеток окислы железа. Кроме L. ochracea, описан ряд других видов Leptothrix, но сведения о них также весьма ограничены.
Второй организм, который давно привлекает к себе внимание в связи с особенностями морфологии и физиологических свойств, — это Gallionella. Выделяют несколько видов, наиболее известен Gallionella ferruginea. Согласно описаниям Н. Г. Холодного, Gallionella состоит из бобовидных отдельных клеток, которые выделяют с вогнутой стороны гидрат окиси железа, образующего переплетенные нити. Более поздние работы с использованием электронной микроскопии подтвердили, что в культурах Gallionella встречаются вибриоидные клетки со жгутиками. От таких клеток могут отходить стебельки в виде нитей, состоящих из отдельных волокон. Обнаружено также наличие на нитях расширений (мембранных мешков) и мелких округлых телец, похожих на почки. Химические реакции доказывают наличие в нитях белка. Все это говорит о том, что данные образования не являются чисто гидратом окиси железа, а, видимо, имеют «живые элементы». Работы последних лет позволяют предполагать, что под названием Gallionella описаны комплексные культуры, один из компонентов которых, видимо, относится к микоплазмам. Очевидно, вопрос о природе Gallionella будет совсем решен после выделения несомненно чистых культур. Пока таковых не имеется, хотя накопительные культуры получить довольно просто. Для этого используют минеральную среду, содержащую сульфид железа или металлическое железо, и обеспечивают снабжение углекислотой. Тот факт, что Gallionella растет на такой среде и фиксирует 14С02, говорит о возможности ее существования в автотрофных условиях.
Для окончательных выводов необходимы дальнейшие исследования.
Сведения о других микроорганизмах, перечисленных выше, еще более ограничены. Есть основания полагать, что в число железобактерий попало немало микроорганизмов, для которых процесс окисления железа не имеет какого-либо физиологического значения, но они могут концентрировать железо в слизи, окружающей клетки, когда в результате изменения условий оно окисляется химическим путем и переходит в нерастворимую форму. Такая способность обнаружена у многих нитчатых бактерий и сине-зеленых водорослей. Описаны также случаи отложения окислов железа на водной растительности.
Однако известны действительно хемоавтотрофиые микроорганизмы, которые получают энергию в результате окисления записного железа. Таковым является Thiobacillus ferrooxidans. Как уже указывалось выше, по своей морфологии и физиологическим свойствам этот микроорганизм, несомненно, принадлежит к к тионовым бактериям. Th. ferrooxidans в отличие от других представителей тиобацилл способен окислять соединения не только серы,
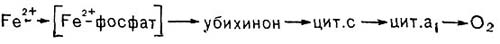
Рис. 141. Цепь переноса электрона при окислении железа у Thiobacillus ferrooxidans.
но и двухвалентного железа. Клетки этой грамотрицательной бактерии имеют вид коротких палочек (0,3—0,4 X 0,7 — 1,7 мкм) с одним полярным жгутиком. Размножаются поперечным делением. Оптимальное значение рН для роста<4,0 (1,8—3,5), температуры 28—30 °С. Растет на простых синтетических средах с аммонием или нитратами в аэробных условиях. Окисляет молекулярную серу и различные ее соединения (S2, S2O32-, S2042-, S4062-, S032-), в том числе сульфиды тяжелых металлов. Поэтому широко распространен в месторождениях различных сульфидных минералов. Окисление Т. ferrooxidans двухвалентного железа происходит согласно уравнению
4Fe2++4H++6S042-+02 -> 2Fe2(S04)3+ 2Н20, дельта F = —46,2*103 дж.
Поскольку реакция сопровождается малым выходом энергии (46,2 -103 дж/г окисленного железа), то для поддержания роста бактериям приходится окислять весьма большие количества железа. Так, при образовании 1 г сырой биомассы происходит окисление 500 г сернокислого железа. Образование Т. ferrooxidans АТФ сопряжено с функционированием электрон-транспортной дыхательной цепи, которая, как и у ряда других хемоавтотрофов, укорочена. Это связано с тем, что Fe2+ имеет весьма высокий положительный потенциал (Е-0= 0,77 В). Полагают, что сначала железо образует с фосфатом комплексное соединение, имеющее более низкий окислительно-восстановительный потенциал (Е2-0 = О В), и лишь затем передает электрон в дыхательную цепь (рис. 141) на уровне либо убихинона, либо цитохрома. Поэтому образование восстановленного НАД Т. ferrooxidans происходит в результате действия системы обратного переноса электрона с затратой энергии.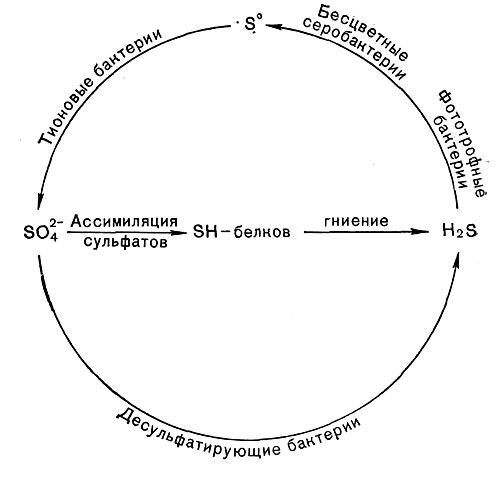
Рис. 142. Схема круговорота серы.
Т. ferrooxidans обычно выращивают на минеральных средах, содержащих углекислоту и восстановленные соединения серы или соли двухвалентного железа. Лишь недавно появились сообщения о способности некоторых штаммов этих бактерий расти на среде с глюкозой в отсутствие неорганических окисляемых субстратов. Однако способность Т. ferrooxidans к переключению на такой гетеротрофный метаболизм требует дальнейшего изучения и проверки.
До последнего времени не было известно других бактерий, способных, подобно Т. ferrooxidans, расти в автотрофных условиях, окисляя двухвалентное железо. Однако сейчас такая возможность показана еще у двух микроорганизмов. Один из них, как уже указывалось выше, принадлежит к дольчатым бактериям Sulfolobus и способен, кроме железа, окислять молекулярную серу. Второй микроорганизм представляет собой небольших спирилл и растет на минеральной среде, окисляя железо. Он назван Leptospirillum ferrooxidans. Есть также сообщения, что такой способностью обладают некоторые представители рода Metallogenium.
Имеющиеся данные позволяют заключить, что автотрофные и некоторые гетеротрофные микроорганизмы принимают участие в превращениях железа в природе, в частности в образовании железистых отложений, из которых формируются осадочные железные руды в болотах, озерах и других водоемах.
Весьма существенное значение имеет также деятельность Т. ferrooxidans в месторождениях сульфидных руд. Способность Т. ferrooxidans окислять практически все известные сульфидные минералы находит практическое применение в гидрометаллургии.
Тионовые бактерии принимают также активное участие в круговороте серы (рис. 142).
В заключение следует отметить, что некоторые микроорганизмы способны окислять и концентрировать вокруг себя не только железо, но и марганец (Mn+2 -> Мn+4). Таким свойством обладает ряд нитчатых бактерий, а именно: некоторые представители Leptothrix (например, L. discophora), Crenothrix polyspora, Lieskeela discophora, а также Naumannilla, Kuznezovia polymorpha, Blastocaulis, Siderocapsa и Hyphomicrobium. Известны формы, окисляющие только марганец. К числу таковых принадлежат некоторые почкующиеся бактерии из родов Hyphomicrobium и Metallogenium. Один из них, Metallogenium symbioticum, выделенный Г. А. Заварзиным, растет в симбиозе с грибом и, как установлено Г. А. Дубининой, относится к микоплазмам. К этому организму, видимо, близок Caulococcus manganifer, также окисляющий марганец. Кроме того, показано, что окислять марганец могут разные почвенные грибы и ряд бактерий таких родов, как Bacillus, Pseudomonas, Achromobacter, Flavobacterium, Corynebacterium, Sarcina, Escherichia и др.
Часто, однако, окисление марганца происходит только в смешанных или симбиотиче-ских культурах.
По всем данным микробиологические процессы имеют большое значение в превращениях марганца и в почве и в разных водоемах, где нередко происходит отложение марганца и образование железомарганцевых конкреций. Однако ни для одного марганецокисляющих микроорганизмов не показана способность к росту в автотрофных условиях. И хотя предположения о возможности получения ими энергии при окислении марганца
4MnC03+02 -> 2Mn203+2C02, дельта F = — 31,9 * 104 Дж
высказывались, они остаются не доказанными.
Таблица 44. Палочковидные бактерии (по) и бактероиды из клубеньков чины, вики, акации (увел, х 6000—10 000).

Таблица 45. Бактериоз пшеницы: 1,2 — базальный; 3 — желтый слизистый.









